
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
分析 计算出稀释后NaHCO3溶液的中NaHCO3的物质的量,最后溶液的体积都为50mL,则NaHCO3的物质的量越大,NaHCO3浓度越大,而浓度越大、温度越高,反应速率越快.
解答 解:A.20mL3mol/L的NaHCO3溶液,NaHCO3的物质的量为0.02L×3mol/L=0.06mol;
B.30mL2mol/L的溶NaHCO3液,NaHCO3的物质的量为0.03L×2mol/L=0.06mol;
C.10mL4mol/L的NaHCO3溶液,NaHCO3的物质的量为0.01L×4mol/L=0.04mol;
D.10mL2mol/L的NaHCO3溶液,NaHCO3的物质的量为0.01L×2mol/L=0.02mol,
显然四种情况下,NaHCO3浓度A=B>C>D,而温度B=C>A=D,故反应速率B的反应速率最快,
故选B.
点评 本题考查化学反应速率影响因素,涉及温度、浓度对反应速率的影响,难度不大,注意利用控制变量法进行分析解答.


科目:高中化学 来源: 题型:解答题
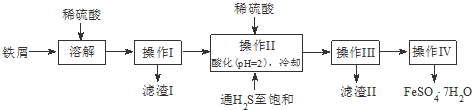
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
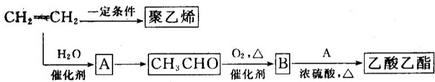
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
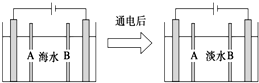
| A. | 阳离子交换膜是A,不是B | |
| B. | 通电后阳极区的电极反应式:2Cl--2e-═Cl2↑ | |
| C. | 工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 | |
| D. | 阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
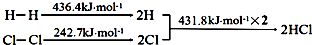
| A. | H-H键比Cl-Cl键稳定 | |
| B. | △H=-184.5 kJ•mol-1 | |
| C. | 正反应活化能比逆反应活化能高 | |
| D. | 在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.16mol•L-1 | C. | 0.32mol•L-1 | D. | 0.08mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com