
| A. | 0.2 | B. | 0.7 | C. | 1.0 | D. | 2.0 |
分析 100mL0.6mol•L-1盐酸加到等体积0.4mol•L-1NaOH溶液中,盐酸过量,混合后溶液显酸性,故应根据氢离子浓度c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$计算出溶液的pH,据此分析.
解答 解:100mL0.6mol•L-1盐酸加到等体积0.4mol•L-1NaOH溶液中,盐酸过量,混合后溶液显酸性,故混合后溶液中的氢离子浓度c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$=$\frac{0.6mol/L×0.1L-0.4mol/L×0.1L}{0.2L}$=0.1mol/L,故pH=1,故选C.
点评 本题考查酸酸混合pH的计算,明确浓度与pH的换算是解答本题的关键,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
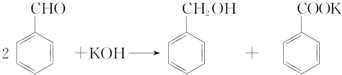
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
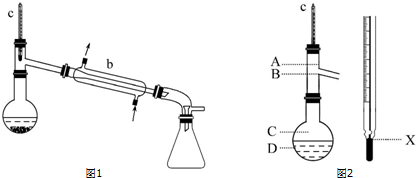
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1的蔗糖溶液 | B. | 0.01 mol•L-1的CaCl2溶液 | ||
| C. | 0.02 mol•L-1的NaCl溶液 | D. | 0.02 mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 往盐酸中滴加紫色石蕊试液,溶液变红色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com