
苯可被臭氧分解,发生如下化学反应: ,二甲苯通过上述反应可能的产物为:
,二甲苯通过上述反应可能的产物为: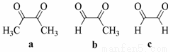 ,若邻二甲苯进行上述反应,对其反应产物描述正确的是
,若邻二甲苯进行上述反应,对其反应产物描述正确的是
A.产物为a、b、c,其分子个数比为a:b:c=1:2:3
B.产物为a、b、c,其分子个数比为a:b:c=1:2:1
C.产物为a和c,其分子个数比为a:c=1:2
D.产物为b和c,其分子个数比为b:c=2:1
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:2015-2016学年重庆市高一下期中化学试卷(解析版) 题型:选择题
下列实验不能达到预期目的的是
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | NaCO3溶液中加入稀H2SO4 | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:简答题
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O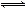 Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
下列实验基本操作或对事故的处理方法不正确的是( )
A.给盛有液体的烧瓶加热时,需要加碎瓷片或沸石
B.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
C. 不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹10%的NaOH溶液
D.中和滴定实验时,不必润洗锥形瓶
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一实验班下期中化学试卷(解析版) 题型:填空题
【加试题】U、V、W、X、Y、Z属于原子序数依次增大的六种短周期主族元素,它们之间的关系如下:
Ⅰ.元素原子的核电荷数:U+V+W=Y
Ⅱ.U可分别和V、W、Y、Z形成具有相同电子数的共价化合物甲、乙、丙、丁
Ⅲ.W、V元素原子的最外层电子数之和与之差分别等于X元素原子的核外电子数与最外层电子数
请回答下列问题:
(1)写出下列元素的名称:X ;乙的结构式 。
(2)由U、W、X、Y四种元素形成的一种相对分子质量为120的化合物,溶于水时破坏的是 。
A.共价键 B.离子键 C.金属键 D.氢键 E.分子间作用力
(3)高压下V的单质会聚合生成高聚物,这种高聚物的晶体中每个V原子都通过三个单键与其它V原子结合形成空间立体网状结构(如图),则其晶体类型是 ,它与V的单质之间的关系属于 。
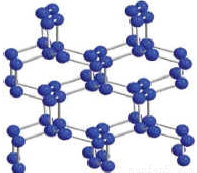
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一实验班下期中化学试卷(解析版) 题型:选择题
某有机 物的结构为下图所示,这种有机物不可能具有的性质是
物的结构为下图所示,这种有机物不可能具有的性质是
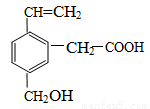
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;
④能发生酯化反 应;⑤能发生加聚反应;⑥能发生水解反应
应;⑤能发生加聚反应;⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一实验班下期中化学试卷(解析版) 题型:选择题
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60是原子晶体 D.H2与H3属于同素异形体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:简答题
如下图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深。请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为__________。
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀。他测得溶液的pH=5,则此时溶液中c(Fe3+)=__________mol/L。(己知Ksp[Fe(OH)3]=1×10-36)。
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL。当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为:__________。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏中卫一中高一下第三次月考化学试卷(解析版) 题型:实验题
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验。
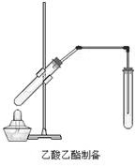
(1)写出左试管中主要反应的方程式:______________________________。
(2)加入浓硫酸的作用:_____________________________________。
(3)饱和Na2CO3的作用是: _____________________________________________。
(4)反应开始时用酒精灯对左试管小火加热的原因是______________________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(5)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称)______________,所需主要仪器为 。
(6)实验生成的乙酸乙酯,其密度比水 ,有 气味。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com