
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |


分析 (1)由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F;
(2)⑧的单质为Cl2,分子中氯原子之间形成1对共用电子对;
(3)⑤为Al,原子核外有13个电子,有3个电子层,各层电子数为2、8、3;
(4)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(5)金属性越强,最高价氧化物对应水化物的碱性越强;同周期自左而右原子半径减小;
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为Al,其最高价氧化物为Al2O3,与盐酸反应生成氯化铝与水,与氢氧化钠溶液反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F.
(1)①为Na元素,故答案为:Na;
(2)⑧为Cl,单质为Cl2,电子式为 ,故答案为:
,故答案为: ;
;
(3)⑤为Al,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中F的非金属性最强,K的金属性最强,
故答案为:⑩;⑪;②;
(5)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,同周期自左而右原子半径减小,故原子半径:Na>Mg>Al,
故答案为:NaOH;Na>Mg>Al;
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为Al,其最高价氧化物为Al2O3,与盐酸反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,与氢氧化钠溶液反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+6HCl=2AlCl3+3H2O;Al2O3+2NaOH=2NaAlO2+H2O.
点评 本题考查元素周期表与元素周期律的应用,难度不大,注意对元素周期律的理解掌握.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
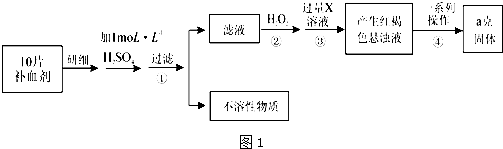
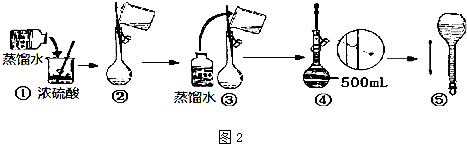
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
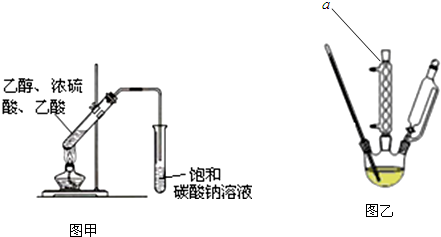
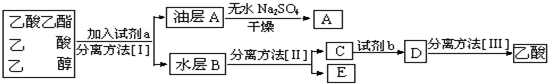
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
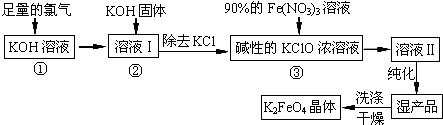

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 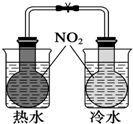 证明温度对平衡移动的影响 | B. | 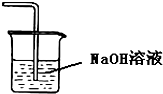 吸收HCl尾气 | ||
| C. | 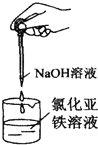 制备氢氧化亚铁 | D. | 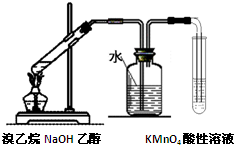 验证溴乙烷消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
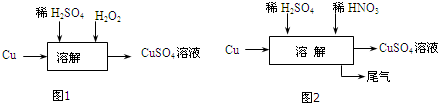
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com