
分析 电解池书写电极反应式,应先确定电极名称,然后找出放电离子,依据氧化还原反应规律书写,注意电荷、得失电子数应守恒,由此分析解答.
解答 解:与电源正极相连的是阳极,阳极发生氧化反应,阳极氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑;与电源负极相连的是阴,阴极发生还原反应,电极反应式为:Ag++e-=Ag;阴、阳电极反应式之和为总反应式,总反应式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,放氧生成酸型,所以电解一段时间溶液的PH值减小,故答案为:4OH--4e-=2H2O+O2↑;Ag++e-=Ag;4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;下降.
点评 本题考查电解原理,难度不大,掌握电极反应式的书写是重点,学生应清楚阳极发生氧化反应,阴极发生还原反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 将NO2通入水中,红棕色消失:3NO2+H2O═2HNO3+O2 | |
| B. | 向含有Hg2+的废水中加入Na2S 产生沉淀:Hg2++S2-═Hg+S↓ | |
| C. | Na 与水反应产生气体:2Na+H2O═2Na++2OH-+H2↑ | |
| D. | 向燃煤中加入石灰石可减少 SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:饱和食盐水和HCl | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
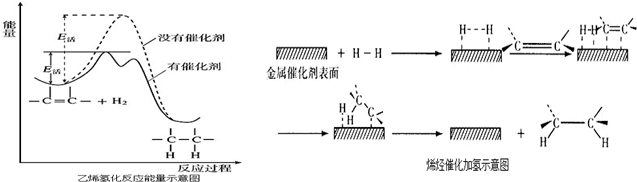
| A. | 乙烯和H2生成乙烷的反应是吸热反应 | |
| B. | 加入催化剂,可减小反应的热效应 | |
| C. | 催化剂能改变平衡转化率,不能改变化学反应的平衡常数 | |
| D. | 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中可能含有K+ | |
| B. | 广泛pH试纸测得某新制氯水的pH为4 | |
| C. | 配制240ml某溶液,应选240ml容量瓶 | |
| D. | 可用排饱和食盐水来收集纯净的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
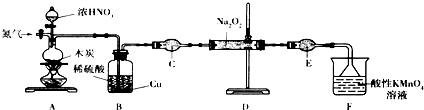
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com