
【题目】下面是以有机物A合成聚酯类高分子化合物F的路线:

已知:
回答下列问题:
(1)A生成B的反应类型为_____,C中的官能团名称为________。
(2)D与NaOH水溶液反应的化学方程式为________。
(3)①E生成F的化学方程式为________。
②若F的平均相对分子质量为20000,则其平均聚合度为________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环状结构的G。G的结构简式为________。
(5)满足下列条件的C的同分异构体有_____种。(不考虑立体异构)
①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与斐林试剂反应产生2mol砖红色沉淀
(6)写出用![]() 为原料制各化合物
为原料制各化合物 的合成路线______。(其他试剂任选)
的合成路线______。(其他试剂任选)
【答案】 氧化反应 碳碳双键、酯基 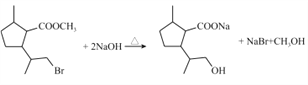
 C
C 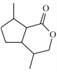 12
12 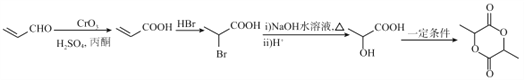
【解析】(1)根据C的结构可推断B→C为酯化反应,则B的结构简式为: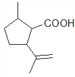 ;A→B为醛基转化为羧基,故A→B为氧化反应。C中含有两种官能团,分别为:碳碳双键和酯基。
;A→B为醛基转化为羧基,故A→B为氧化反应。C中含有两种官能团,分别为:碳碳双键和酯基。
故答案为:氧化反应;碳碳双键、酯基。
(2)根据已知信息可推断D的结构简式为: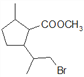 ,D在NaOH水溶液中发生水解反应,其中溴原子和酯基均发生水解,故每1分子D消耗2molNaOH,水解方程式为:
,D在NaOH水溶液中发生水解反应,其中溴原子和酯基均发生水解,故每1分子D消耗2molNaOH,水解方程式为: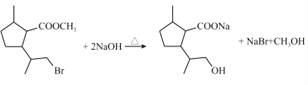 ;
;
(3)① 在NaOH条件下水解生成
在NaOH条件下水解生成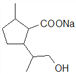 ,酸化后得到E,E为:
,酸化后得到E,E为: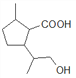 。E具有羧基和羟基,可以发生缩聚反应,得到高分子化合物F。E→F的方程式为:
。E具有羧基和羟基,可以发生缩聚反应,得到高分子化合物F。E→F的方程式为:
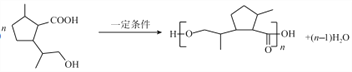 ;
;
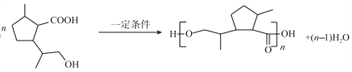
②E的分子式为C10H18O3,相对分子质量为186,则F的链节的相对分子量为(186-18)=168,则高分子F的平均聚合度为![]() =119。
=119。
(4)E为: ,其中羧基和羟基可以发生自身酯化,形成1个六元环。则E自身酯化后形成的物质G结构简式为:
,其中羧基和羟基可以发生自身酯化,形成1个六元环。则E自身酯化后形成的物质G结构简式为: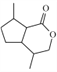 .
.
(5)C为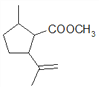 ,共有11个碳原子,2个氧原子,不饱和度为3。C的同分异构体中含有1个六元环,环不饱和度为1;1mol该物质与斐林试剂反应产生2mol砖红色沉淀,则该物质每分子应含有2个-CHO,每个醛基的不饱和度为1,所以该物质除醛基外不含其他不饱和键。六元环及2个醛基共用去8个C原子,还剩下3个饱和碳原子可作环上的取代基。环上相邻4个碳原子上各连有一个取代基,共4个取代基,2个醛基与另外3个碳组成这4个取代基,所以4个取代基可以有两种组合:①-CHO、-CH3、-CH3、-CH2CHO;②-CHO、-CHO、-CH3、-CH2CH3。C的同分异构体分别为:
,共有11个碳原子,2个氧原子,不饱和度为3。C的同分异构体中含有1个六元环,环不饱和度为1;1mol该物质与斐林试剂反应产生2mol砖红色沉淀,则该物质每分子应含有2个-CHO,每个醛基的不饱和度为1,所以该物质除醛基外不含其他不饱和键。六元环及2个醛基共用去8个C原子,还剩下3个饱和碳原子可作环上的取代基。环上相邻4个碳原子上各连有一个取代基,共4个取代基,2个醛基与另外3个碳组成这4个取代基,所以4个取代基可以有两种组合:①-CHO、-CH3、-CH3、-CH2CHO;②-CHO、-CHO、-CH3、-CH2CH3。C的同分异构体分别为: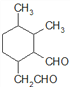 、
、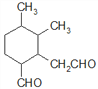 、
、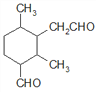 、
、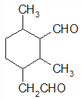 、
、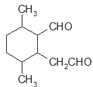 、
、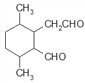 、
、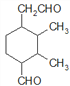 、
、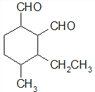 、
、 、
、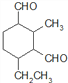 、
、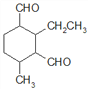 、
、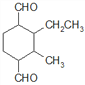 ,共12种。
,共12种。
(6合成目标为环酯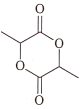 ,该环酯可由2分子
,该环酯可由2分子![]() 自身酯化得到,所以先要实现
自身酯化得到,所以先要实现![]() →
→![]() 。根据题干中的流程A→B的信息,可将-CHO氧化为-COOH,根据题干中C→D→E的信息,可通过先加成再水解的方式得到羟基。流程可表示如下:
。根据题干中的流程A→B的信息,可将-CHO氧化为-COOH,根据题干中C→D→E的信息,可通过先加成再水解的方式得到羟基。流程可表示如下: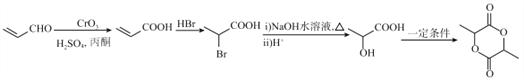 。
。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可得到A,若向A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断:
(1)A是 , B是 , C是 , D是 .
(2)完成有关化学方程式:C→A , A→C , B+C→A .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是硫酸试剂标签上的部分内容,据此下列说法错误的是
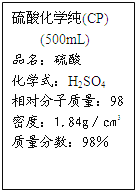
A. 该硫酸试剂的物质的量浓度为18.4mol/L
B. 该硫酸与等体积的水混合所得溶液的质量分数大于49%
C. 配制1.0mol /L的80mL 稀硫酸的实验过程中需要5mL量简、胶头滴管、100mL容量瓶等玻璃仪器
D. 一定条件下,将6.4gCu加入到足量该硫酸中可得到标准状况下的气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。下列推断不正确的是

A. 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐
B. 若X是Na2S,C是气体,则A可能是氯气,且D和E能发生反应
C. 若D为CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种
D. 若A是单质,B和D的反应是生成C,则E能还原Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
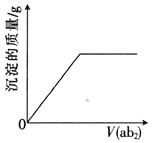
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、钠及其化合物的性质都类似。回答下列问题:
(1)单质钾与钠相比,熔沸点:K ____(填“>”“<” 或“=”,下同) Na;密度:K____Na。
(2)超氧化钾(KO2)与过氧化钠都能吸收CO2生成碳酸盐和氧气,因此均可用作急救供氧剂。写出超氧化钾与CO2反应的化学方程式:________
(3)若KO2和Na2O2分别与CO2反应时,欲得到等量的氧气,则所需KO2与Na2O2的物质的量之比为________,此时两反应转移的电子数之比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com