
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的过程中有氧化还原反应发生 | |
| D. | 该冶炼锌的方法属于热还原法 |
分析 依据题意可知:碳酸锌与碳在高温下反应生成锌和一氧化碳,化学方程式:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,得到的锌为倭铅,据此解答.
解答 解:A.由题意可知,倭铅是指金属锌,不是混合物,故A错误;
B.反应中C作还原剂,则煤炭中起作用的主要成分是C,故B正确;
C.碳酸锌与碳在高温下反应生成锌和一氧化碳,化学方程式:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,故C正确;
D.依据方程式可知ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,该反应是利用碳还原碳酸锌生成锌单质,属于热还原法,故D正确;
故选A.
点评 本题考查了金属的冶炼,准确把握题干信息,明确发生的反应及锌的性质是解题关键,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
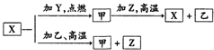 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )| A. | Y是Cl2、Z是H2 | |
| B. | 甲为Fe3O4 | |
| C. | X2+能使苯酚呈紫色 | |
| D. | 甲与Z高温下反应的化学方程式为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:YX>W单质>WZ2;离子半径:Z2->Y+>X3+ | |
| B. | YXWZ3中既有离子键又有共价键,其溶液存在多种平衡,溶液呈酸性 | |
| C. | Y与W形成原子数目之比为1:1化合物的电子式表示形式为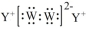 | |
| D. | X2WZ4在水中能电离:X2WZ4=2X++WZ42-,所以X2WZ4为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题.
现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题. 如图,违背了泡利不相容原理.
如图,违背了泡利不相容原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
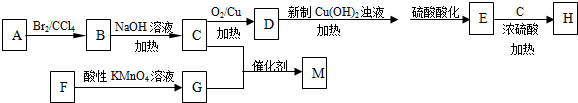
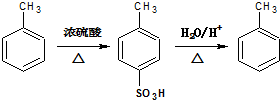
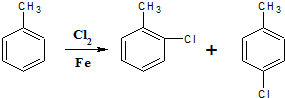 ;
;
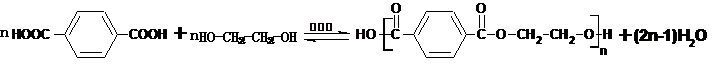
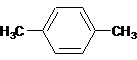
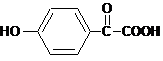 .
.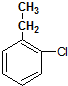 .
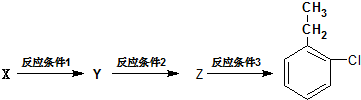
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
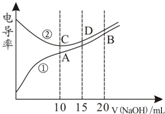 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:2c(Na+)=3c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )| A. | 电极a为电池负极,发生还原反应 | |
| B. | 每消耗1mol VB2转移6mol电子 | |
| C. | 电池工作时,OH-向电极a移动 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-→V2O5+2B2O3+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在混合液中加入氢氧化钠溶液,充分振荡后分液 | |
| B. | 在混合液中加人一定量的浓硫酸和乙醇,加热,将乙酸转化为乙酸乙酯 | |
| C. | 在混合液中加人足量的水.充分振荡后分液 | |
| D. | 在混合液中加入适量的饱和碳酸钠溶液,充分振荡后分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com