

分析 某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02,加入足量稀硫酸过滤,Cu2O溶于酸反应生成铜和铜盐,所以固体混合物B为Cu、Si02,滤液A中为亚铁离子、铝离子和铜离子,加入足量氢氧化钠溶液过滤得到固体混合物D为氢氧化铜、氢氧化铁,滤液为C为AlO2-离子,通入二氧化碳生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,电解熔融氧化铝得到金属E为Al,固体混合物D空气中加热灼烧得到氧化铁和氧化铜,和铝发生铝热反应得到粗铜,含有铁杂质,粗铜精炼得到精铜;固体混合物B中加足量的NaOH溶液,过滤,滤渣为Cu,滤液为硅酸钠溶液;结合物质的性质分析解答.
解答 解:某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02,加入足量稀硫酸过滤,Cu2O溶于酸反应生成铜和铜盐,所以固体混合物B为Cu、Si02,滤液A中为亚铁离子、铝离子和铜离子,加入足量氢氧化钠溶液过滤得到固体混合物D为氢氧化铜、氢氧化铁,滤液为C为AlO2-离子,通入二氧化碳生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,电解熔融氧化铝得到金属E为Al,固体混合物D空气中加热灼烧得到氧化铁和氧化铜,和铝发生铝热反应得到粗铜,含有铁杂质,粗铜精炼得到精铜;固体混合物B中加足量的NaOH溶液,过滤,滤渣为Cu,滤液为硅酸钠溶液,
(1)Cu2O溶于酸反应生成铜和铜盐,其反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O;
故答案为:Cu2O+2H+=Cu2++Cu+H2O;
(2)Cu2O溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子,所以滤液A中为亚铁离子,检验亚铁离子方法为:先加KSCN溶液,若不变色,再加氯水,变红色,说明含有亚铁离子;
故答案为:Fe2+;硫氰化钾溶液和氯水;
(3)由分析可知,固体混合物B主要含有Cu、Si02,二氧化硅晶体可以用来制备光导纤维;
故答案为:Cu、Si02;光导纤维;
(4)金属Al与氧化铁和氧化铜发生置换反应生成金属单质,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu;
(5)将Na2CO3溶液滴入到一定量的FeCl3溶液中,生成二氧化碳和氢氧化铁沉淀,其反应的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
故答案为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(6)用酸性高锰酸钾溶液滴定发生的反应为5Fe2++MnO42-+8H+=5Fe2++Mn2++4H2O,消耗的高锰酸钾为0.1mol/L×0.02L=0.002mol,则参加反应的亚铁离子为0.002mol×5=0.01mol,所以Fe203的物质的量为0.005mol,其质量为0.005mol×160g/mol=0.8g,所以该铜矿石中Fe2O3的含量为$\frac{0.8g}{10g}$×100%=8%;
故答案为:8%.
点评 本题考查了分离提纯的方法和基本操作的综合应用,题目涉及铜的单质及其化合物的性质及转化、离子检验、化学方程式、氧化还原滴定等,涉及范围较广,综合性较强,题目难度中等,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
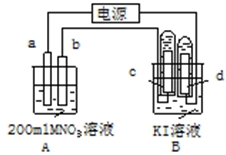 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由ZR组成的化合物为离子化合物 | B. | 含氧酸酸性R>X | ||
| C. | X、Y只能共存于共价化合物中 | D. | 原子半径Z>R>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | ||
| A | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 将砂纸打磨过的铝箔置于酒精灯外焰上灼烧,熔化的铝以小液滴的形式滴落下来 | Al的熔点低,加热时Al熔化 |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无Κ+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 用氯化铁溶液腐蚀铜板:Fe3++Cu═Cu2++Fe2+ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数由少到多的顺序:X=W<Y<Z | |
| B. | 原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 元素非金属性由强到弱的顺序:X、Y、W | |
| D. | 元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
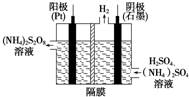 (1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.
(1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 目的 | 操作 |
| A | 配置100mL 1.0mol•L-1CuSO4溶液 | 将25gCuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去KNO3固体中少量NaCl | 将混合物制成熟的饱和溶液,冷却结晶,过滤 |
| C | 提取溴水中的Br2 | 向溶液中加入乙醇后振荡,静置,分液 |
| D | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置 一块湿润的红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com