
硒元素能提高人体免疫力,有延年益寿、抗衰老、抗癌的作用。中国地质调查局在广东陆续发现大片富硒土壤,面积达3万多平方公里,富硒土壤分布面积之广,位居全国前列,富硒农产品的开发具有广阔的前景。但是硒单质是一种环境污染物,可通过与浓H2SO4反应生成SeO2 以回收Se。在回收过程当中涉及到两个化学反应:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2H2SO4 。下列有关叙述正确的是( )
A.SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2
B.①中SO2 是氧化产物,SeO2 是还原产物
C.反应②中SO2 是氧化剂,SeO2 是还原剂
D.反应①中每有1 mol SeO2 生成,转移电子数目为2NA
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2015-2016学年陕西省高一下学期期末化学试卷(解析版) 题型:计算题
将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省泰安市高二下学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
B.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C.利用油脂在碱性条件下的水解,可以制甘油和肥皂
D.植物油和矿物油都不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:实验题
I.某实验小组用如图所示的实验装置验证S、C、Si三种元素的非金属性强弱。
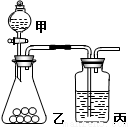
(1)仪器甲的名称为 ,甲中所盛试剂的化学式为 。
(2)乙中盛有白色粉末,可观察到的现象为 。
(3)丙中发生反应的离子方程式为 。
II.另一实验小组用该套装置验证氧化性 KMnO4>Cl2>I2 (已知高锰酸钾常温下可氧化浓盐酸生成氯气)。
(4)写出乙中发生反应的离子方程式: 。
(5)丙中盛有KI溶液和苯的混合物,丙中观察到的现象为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.Na2O2 和Na2O中阴、阳离子个数比分别为1:1和1:2
B.CaH2中既有离子键,又有共价键
C.用铂丝蘸取某溶液灼烧,观察到火焰呈黄色,则可判断溶液中有钠元素,没有钾元素
D.镁铝合金常用作宇宙飞船、火箭、导弹、飞机中某些部件的金属材料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是( )
A.甲烷、乙烯和苯在工业上都可以通过石油分馏得到
B.煤中含有苯、甲苯、二甲苯等有机物,可通过干馏分离出这些物质
C.甲烷、乙烯、乙醇都能发生氧化反应
D.汽油、柴油属于烃,植物油属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省通渭县高二下期末理综化学试卷(解析版) 题型:简答题
【化学——选修3物质结构与性质】已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增. R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
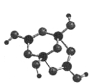
(1)写出Z的基态原子的外围电子排布式_____。
( 2)R的某种钠盐晶体,其阴离子Am- (含R、W、氢三种元素)的球棍模型如上图所示: 在Am- 中,R原子轨道杂化类型有_____ ;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原 子 所构成的立体几何构型为_____。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]S04,下列说法正确的是_____
A. [Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B. 在[Z(NH3)4 ]2+中Z2+给出孤对电子,NH3提供空轨道
C. [Z(NH3)4]SO4的组成元素中第一电离能最大的是氧元素
D. SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6- 构成的离子晶体,其晶体结构与CsCl相似。若晶胞边长为a pm,则晶胞的密度为_____g•cm-3.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京市高二下期末化学试卷(解析版) 题型:选择题
实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19 g·cm-3,则物质的量浓度是( )
A.11.9 B.11.9 mol·L-1 C.0.012 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷(解析版) 题型:实验题
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com