
| ¢ŁCH3COOH | ¢ŚH2CO3 | ¢ŪH2S | ¢ÜH3PO4 |
| K=1.8”Į10-5 | K1=4.3”Į10-7 K2=5.6”Į10-11 | K1=9.1”Į10-8 K2=1.1”Į10-12 | K1=7.5”Į10-3 K2=6.2”Į10-8 K3=2.2”Į10-13 |
·ÖĪö £Ø1£©ĖįµÄµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ŌņĖįµÄµēĄė³Ģ¶ČŌ½“ó£¬ĘäĖįŠŌŌ½Ē棻
£Ø2£©ĖįµÄµēĄėĘ½ŗā³£ŹżŌ½Š”£¬ĖįµÄĖįŠŌŌ½Čõ£¬Ęä¶ŌÓ¦ĖįøłĄė×Ó½įŗĻĒāĄė×ÓÄÜĮ¦Ō½Ē攢Ė®½ā³Ģ¶ČŌ½“ó£®
½ā“š ½ā£ŗ£Ø1£©ĻąĶ¬Ģõ¼žĻĀ£¬ĖįµÄµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ĘäĖįŠŌŌ½Ē棬¶ąŌŖČõĖįµÄĖįŠŌ¾ö¶ØÓŚŅ»¼¶µēĄė£¬ĖłŅŌĖÄÖÖĖįµÄĖįŠŌH3PO4£¾CH3COOH£¾H2CO3£¾H2S£¬
¹Ź“š°øĪŖ£ŗ¢Ü¢Ł¢Ś¢Ū£»
£Ø2£©ĻąĶ¬Ģõ¼žĻĀ£¬ĖįµÄµēĄėĘ½ŗā³£ŹżŌ½Š”£¬ĘäŌ½ÄѵēĄė£¬ĘäĖįøłĄė×ÓŌ½ČŻŅ×Ė®½ā£¬ĖłŅŌĶ¬ÅØ¶ČµÄCH3COO-”¢HCO3-”¢CO32-”¢S2-Ė®½āÄÜĮ¦ÓÉČõµ½Ē棬½įŗĻH+µÄÄÜĮ¦ÓÉĒæµ½ČõµÄĖ³ŠņĪŖ¢Ü¢Ū¢Ś¢Ł£¬¹Ź“š°øĪŖ£ŗ¢Ü¢Ū¢Ś¢Ł£®
µćĘĄ ±¾Ģāæ¼²éČõµē½āÖŹµÄµēĄė£¬ĪŖøßĘµæ¼µć£¬Ć÷Č·µēĄėĘ½ŗā³£ŹżÓėĖįŠŌĒæČõ¹ŲĻµ”¢ĖįøłĄė×ÓĖ®½ā³Ģ¶Č¹ŲĻµŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā¶ąŌŖČõĖįøłĄė×ÓÓėĘä¶ŌÓ¦ČõĖįµÄ¹ŲĻµ£¬ČēĢ¼ĖįøłĄė×Ó¶ŌÓ¦µÄĖįŹĒĢ¼ĖįĒāøłĄė×Ó¶ų²»ŹĒĢ¼Ėį£¬ĪŖŅדķµć£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 99”ꏱ£¬Kw=l”Įl0-12 | |
| B£® | pH¼õŠ”µÄŌŅņŹĒHSO4-Ąė×Ó·¢ÉśĮĖĖ®½ā | |
| C£® | ĖęĪĀ¶ČµÄÉżø߶ųŌö“ó | |
| D£® | ČÜŅŗÖŠ£¬Ė®µēĄė³öµÄc£ØH+£©=10-10mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1mol»·±ūĶéÖŠŗ¬ÓŠ¹²¼Ū¼üµÄŹżÄæĪŖNA | |
| B£® | 0.1molCl2Č«²æČÜÓŚĖ®ŗó×ŖŅʵē×ӵďżÄæĪŖ0.1NA | |
| C£® | 2.24LSO3ÖŠŗ¬ÓŠŃõŌ×ӵďżÄæĪŖ0.3NA | |
| D£® | 9.2gÓÉŅŅ“¼ŗĶ¶ž¼×ĆŃ£ØCH3OCH3£©×é³ÉµÄ»ģŗĻĪļÖŠŗ¬ÓŠŃõŌ×ӵďżÄæĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
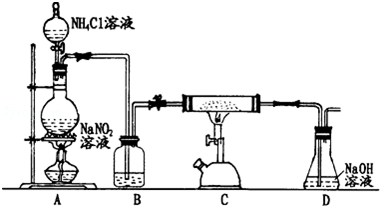
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
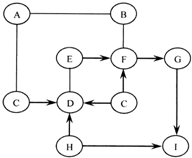 Ķ¼ÖŠA”«IŹĒ³õÖŠ»Æѧ³£¼ūµÄĪļÖŹ£¬ĒŅ·Ö±šŹĒÓÉH”¢C”¢O”¢Na”¢Al”¢S”¢Ca”¢Cu”¢AgÖŠµÄŅ»ÖÖ»ņ¼øÖÖŌŖĖŲ×é³ÉµÄ£®
Ķ¼ÖŠA”«IŹĒ³õÖŠ»Æѧ³£¼ūµÄĪļÖŹ£¬ĒŅ·Ö±šŹĒÓÉH”¢C”¢O”¢Na”¢Al”¢S”¢Ca”¢Cu”¢AgÖŠµÄŅ»ÖÖ»ņ¼øÖÖŌŖĖŲ×é³ÉµÄ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Õō·¢²Ł×÷Ź±£¬Ó¦µČ¼ÓČČÖĮÕō·¢ĆóÖŠŹ£Óą½ĻÉŁŅŗĢåŹ±£¬Į¢¼“Ķ£Ö¹¼ÓČČ | |
| B£® | ÕōĮó²Ł×÷Ź±£¬Ó¦Ź¹ĪĀ¶Č¼ĘŅŗÅŻææ½üÕōĮóÉÕĘæµÄÖ§¹ÜæŚ“¦ | |
| C£® | ·ÖŅŗ²Ł×÷Ź±£¬·ÖŅŗĀ©¶·ÖŠĻĀ²ćŅŗĢå“ÓĻĀæŚ·Å³ö£¬ÉĻ²ćŅŗĢå“ÓÉĻæŚµ¹³ö | |
| D£® | ŻĶČ”²Ł×÷Ź±£¬Ó¦Ń”ŌńÓŠ»śŻĶČ”¼Į£¬ĒŅŻĶČ”¼ĮµÄĆܶȱŲŠė±ČĖ®“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
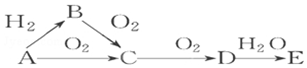 ŅŃÖŖAŹĒĘųĢåµ„ÖŹ£¬EµÄĖ®ČÜŅŗĻŌĒæĖįŠŌ£®A”¢B”¢C”¢D”¢EŹĒŗ¬ÓŠŅ»ÖÖĻąĶ¬ŌŖĖŲµÄĪåÖÖĪļÖŹ£¬ŌŚŅ»¶ØĢõ¼žĻĀæÉ·¢ÉśČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ£®
ŅŃÖŖAŹĒĘųĢåµ„ÖŹ£¬EµÄĖ®ČÜŅŗĻŌĒæĖįŠŌ£®A”¢B”¢C”¢D”¢EŹĒŗ¬ÓŠŅ»ÖÖĻąĶ¬ŌŖĖŲµÄĪåÖÖĪļÖŹ£¬ŌŚŅ»¶ØĢõ¼žĻĀæÉ·¢ÉśČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ąė×Ó°ė¾¶£ŗW£¾Y£¾Z | |
| B£® | ZµÄµ„ÖŹ²»ÄÜÓėĖ®·“Ó¦ | |
| C£® | ¼ņµ„Ēā»ÆĪļµÄ·Šµć£ŗW£¾Y | |
| D£® | ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļµÄĖįŠŌ£ŗX£¾W |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com