
| 元素 | 相关信息 |
| X | X的一种核素的原子核中没有中子 |
| Y | Y原子的核外电子占据4个原子轨道 |
| Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R | R是地壳中含量最高的元素 |
| M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
分析 短周期元素中,X的一种核素的原子核中没有中子,则X为H元素;Z的气态氢化物能使湿润的红色石蕊试纸变蓝,则Z为N元素;Y原子的核外电子占据4个原子轨道,原子序数小于N元素,故Y原子核外电子排布式为1s22s22p2,则Y为C元素;R是地壳中含量最高的元素,则R为O元素;M的单质能与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子,则M为Na,据此解答.
解答 解:短周期元素中,X的一种核素的原子核中没有中子,则X为H元素;Z的气态氢化物能使湿润的红色石蕊试纸变蓝,则Z为N元素;Y原子的核外电子占据4个原子轨道,原子序数小于N元素,故Y原子核外电子排布式为1s22s22p2,则Y为C元素;R是地壳中含量最高的元素,则R为O元素;M的单质能与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子,则M为Na.
(1)同周期所原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素的,故Y、Z、R的第一电离能从大到小的顺序是:N>O>C,
故答案为:N>O>C;
(2)Z、R的最简单氢化物分别为NH3、H2O,非金属性O>N,故稳定性H2O>NH3,常温下水为液体,而安全为气体,故H2O的沸点较高,
故答案为:H2O;H2O;
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10-3mol/L,说明甲为强酸弱碱盐,则甲的化学式是NH4NO3,
故答案为:NH4NO3;
(4)直线型分子C2N2中所有原子都达到8电子稳定结构,则其结构式为N≡C-C≡N,则分子中σ键与π键的个数之比是3:4,
故答案为:3:4;
(5)常温下0.58gC4H10完全燃烧放出29kJ的热量,则1mol C4H10完全燃烧放出热量为29kJ×$\frac{1mol×58g/mol}{0.58g}$=2900kJ,C4H10燃烧热的热化学方程式为:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol,
故答案为:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol.
点评 本题以元素推断为载体,考查电离能、盐类水解、分子结构、热化学方程式书写、元素化合物知识等,正确推断各元素名称为解答关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 用向上排空气法收集氢气 | |
| B. | 往燃着的酒精灯中添加酒精 | |
| C. | 用丁达尔现象鉴别胶体和溶液 | |
| D. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正化合价 (或最低负化合价) | -4 | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硝酸中加入铁粉 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向NaOH溶液中通入CO2气体 | |
| D. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
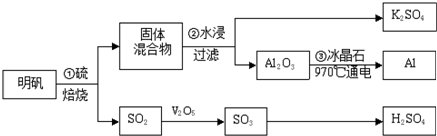
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| B. | 保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| C. | 向0.1 mol•L-1 氨水中加入少量水,pH减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| D. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为氯气有毒,有强氧化性,所以可用于杀菌、消毒、漂白 | |
| B. | 干燥的氯气和氯水均能使鲜花褪色 | |
| C. | 除去氯气中少量氯化氢可使气体通过饱和食盐水 | |
| D. | 氯气能与大多数金属化合,其一般将变价金属氧化至最高价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com