
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到平衡的标志是( )
A.容器内气体密度不随时间变化
B.v(X):v(Y)=1:2
C.容器内X、Y、Z的浓度不随时间变化
D.单位时间消耗0.1molX同时生成0.2molZ
【答案】C
【解析】解:A、容器内气体密度= ![]() ,反应混合物都为气体,根据质量守恒,混合气体的总质量不变,体积为定值,密度自始至终不变,不能说明到达平衡状态,故A错误; B、自反应开始v(X)为v(Y)的
,反应混合物都为气体,根据质量守恒,混合气体的总质量不变,体积为定值,密度自始至终不变,不能说明到达平衡状态,故A错误; B、自反应开始v(X)为v(Y)的 ![]() 倍,所以v(X):v(Y)=l:2,不能说明达平衡,故B错误;
倍,所以v(X):v(Y)=l:2,不能说明达平衡,故B错误;
C、容器内X、Y、Z的浓度不随时间变化,说明反应达到平衡,故C正确;
D、单位时间消耗0.1molX同时生成0.2molZ,说明反应v正(X)=2v正(Y) , 不能说明达平衡,故D错误;
故选:C.
【考点精析】利用化学平衡状态的判断对题目进行判断即可得到答案,需要熟知状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( ) 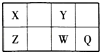
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH,AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示: 
(1)MgCl2的物质的量是mol;
(2)AlCl3的质量是g;
(3)混合物中NaOH的质量是g;
(4)P点所表示盐酸加入体积是mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图1: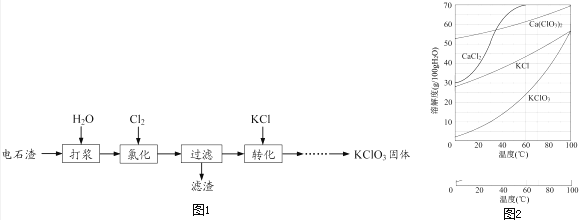
(1)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2 分解为CaCl2和O2 .
①生成Ca(ClO)2的化学方程式为 .
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号).
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:
6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤.
①滤渣的主要成分为(填化学式).
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]1:5(填“>”、“<”或“=”).
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3 , 若溶液中KClO3的含量为100gL﹣1 , 从该溶液中尽可能多地析出KClO3固体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1molL﹣1 . 某同学进行了如图实验: 
(1)根据实验现象判断,滤液X中大量存在的阳离子有;
(2)沉淀A的化学式;沉淀B的化学式;
(3)沉淀C的成分(填“能”或“不能”)确定.若能确定,写出化学式;若不能,说明理由 .
(4)该溶液中一定存在的离子是;一定不存在的离子是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com