
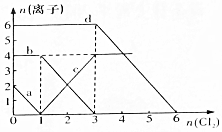
 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:分析 氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,根据还原性强弱为:I->Fe2+>Br->Cl-;
氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,
在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,
通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,
在通入氯气的量为3~6mol的过程中,溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,
据此回答判断.
解答 解:(1)根据还原性强弱为:I->Fe2+>Br->Cl-,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,所以a线代表溶液中的I-;
通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以c线代表溶液中的Fe3+,
故答案为:I-;Fe3+;
(2)通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,
在通入氯气的量为3~6mol的过程中,溴离子从6ml降到0,所以溴离子的物质的量是6mol,故答案为:4mol、6mol;
(3)在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,所以FeI2的物质的量为1mol,故答案为:1mol;
(4)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-;
故答案为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-.
点评 本题考查混合物反应的计算,题目难度中等,侧重考查氧化还原反应中氧化性和还原性强弱的知识,试题综合性较强,正确判断图象中曲线变化的含义为解答本题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
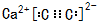 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:实验题
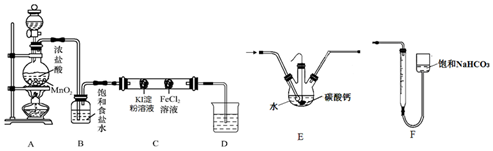
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com