
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、水电离出的c(H+)=10-12mol?L-1的溶液中:Ca2+、K+、Cl、HCO3- | ||
C、
| ||
| D、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


科目:高中化学 来源: 题型:
| A、②③④⑥⑦ | B、①②⑤ |
| C、②⑦⑧ | D、①⑤⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内的固体物质有NaHCO3和Na2O2 |
| B、容器内的气体物质仅有O2 |
| C、容器内没有NaOH |
| D、容器内的气体物质中含有H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应速率加大,逆反应速率变小,平衡正向移动 |
| B、正反应速率变小,逆反应速率加大,平衡逆向移动 |
| C、正反应速率和逆反应速率都变小,平衡正向移动 |
| D、正反应速率和逆反应速率都变小,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
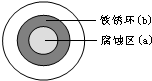 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A、液滴中的Cl-由a区向b区迁移 |
| B、液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- |
| C、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |
| D、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易溶与难溶固体混合物用溶解过滤方法提纯 |
| B、沸点不同的互溶液体可用蒸馏分离 |
| C、用酒精可以从碘水中萃取碘 |
| D、汽油和水的混合物可以用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量CO2通入NaOH溶液中:CO2+2OH-═CO32-+H2O |
| B、NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| C、向氢氧化镁悬浊液中滴加氯化铁溶液,白色沉淀变成红褐色:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
| D、向NaHSO4溶液中滴加Ba(OH)2溶液至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:9 | B、10:1 |
| C、9:1 | D、1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.| n(NH3) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com