
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 乙烯是石油裂解后的产物 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
分析 A.煤中不含有苯及苯的同系物;
B.煤是由古代植物遗体埋在地层下或在地壳中经过一系列非常复杂的变化而形成的.是由有机物和无机物所组成的复杂的混合物,主要含有碳元素?此外还含有少量的氢、氮、硫、氧等元素以及无机矿物质,主要含硅、铝、钙、铁等元素;
C.乙烯是石油裂解的主要产物之一;
D.石油是由烷烃、环烷烃、芳香烃组成的混合物.石油主要由液态烃构成,也溶有少量气态烃和固态烃.
解答 解:A.煤经过干馏发生复杂的物理、化学变化后得到煤焦油等物质,而煤焦油是含有多种芳香族化合物的复杂混合物,在170℃以下蒸馏出来的馏出物里主要含有苯、甲苯、二甲苯和其他苯的同系物等,所以煤中并不含有苯及苯的同系物,故A错误;
B.煤是由有机物和无机物组成的复杂的混合物,故B正确;
C.裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,故C正确;
D.石油是由烷烃、环烷烃、芳香烃组成的混合物.石油主要由液态烃构成,也溶有少量气态烃和固态烃.石油中肯定含有C5-C11的烷烃,因此通过石油炼厂的分馏就可以得到汽油、煤油等分馏产品,故D正确.
故选A.
点评 本题考查石油分馏与裂化、煤的综合利用,以识记为主,难度不大,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 将氯气通入品红溶液 | 溶液红色褪去 | 氯气具有漂白性 |
| B | 将铜粉加入1.0mol•L-1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活泼 |
| C | 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比较低 |
| D | 向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片 | 浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色 | 浓硝酸氧化性强于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
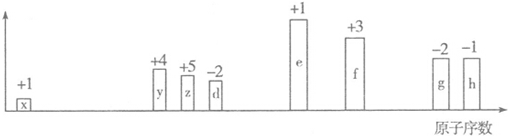
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝 | |
| D. | 生铁、普通钢和不锈钢中的含碳量依次降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com