


科目:高中化学 来源: 题型:
| A、单位时间内消耗n mol O2的同时生成2n mol SO3 |
| B、容器中的总压强不随时间的变化而改变 |
| C、容器中SO2、O2、SO3的物质的量比为2:1:2 |
| D、混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.0 | 0.59 | 0.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
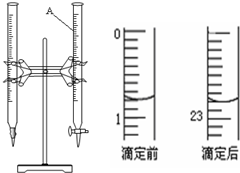 (1)25°C时,NaOH和Na2CO3两溶液的pH均为11.
(1)25°C时,NaOH和Na2CO3两溶液的pH均为11.查看答案和解析>>
科目:高中化学 来源: 题型:
| 主 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com