
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO 、NO
、NO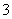
B.使酚酞变红色的溶液:Na+、Cu2+、HCO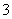 、NO
、NO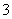
C.0.1 mol·L-1 AgNO3溶液:H+、K+、SO 、I-
、I-
D.0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、SO
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO +Cu2S+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②中电子转移的方向和数目:MnO +CuS
+CuS
Ⅱ.在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。由上述反应得出的物质氧化性强弱的结论是________>________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
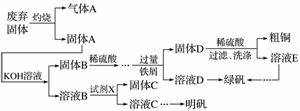
(1)试剂X是________(写化学式)。
(2)配平下列方程式:
MnO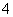 +____SO2+____H2O===____Mn2++____SO
+____SO2+____H2O===____Mn2++____SO +____H+
+____H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g 样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO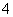 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在______________(填仪器名称)中。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
查看答案和解析>>
科目:高中化学 来源: 题型:
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH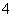 、Mg2+、Al3+、SO
、Mg2+、Al3+、SO 、NO
、NO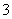 、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
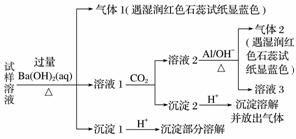
已知:3NO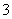 + 8Al+5OH-+2H2O
+ 8Al+5OH-+2H2O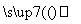 3NH3↑+8AlO
3NH3↑+8AlO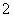
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH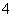 、Mg2+、SO
、Mg2+、SO 和NO
和NO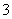
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A.Al3+、Cl-、AlO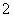 、SiO
、SiO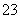
B.H+、Na+、S2-、ClO-
C.K+、Mg2+、SO 、MnO
、MnO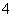
D.Fe3+、Ca2+、SCN-、NO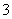
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Na+、Ag+、Al3+、S2-、CO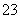 、SO
、SO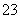 、NO
、NO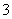 等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
A.一定有S2-、SO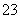 、Na+
、Na+
B.可能只有Na+、S2-、CO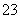
C.一定没有Ag+、Al3+
D.一定有Na+、S2-、NO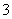
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Na2S2O3在中性或碱性条件下稳定,在酸性条件下会变黄,用离子方程式表示变黄的原因:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C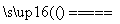 CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2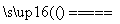 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____________________________________________。
CaCN2中阴离子为CN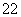 ,与CN
,与CN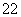 互为等电子体的分子有N2O和________(填化学式),由此可以推知CN
互为等电子体的分子有N2O和________(填化学式),由此可以推知CN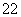 的空间构型为________。
的空间构型为________。
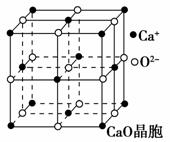
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________。
 (3)三聚氰胺(
(3)三聚氰胺(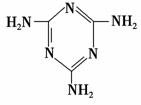 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(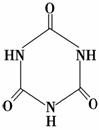 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________。CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________________________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com