
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
A. 一定条件下某密闭容器盛2 mol N2与3 mol H2反应生成的NH3分子数为2NA
B. 25 ℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C. 一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO![]() 和CO
和CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极).下列说法正确的是
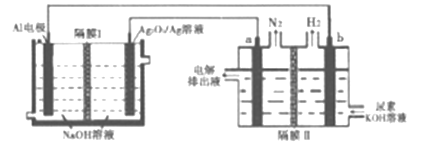
A. Ag电极是正极,反应后该电极区溶液pH减小
B. 原电池的总反应为:2Al+3Ag2O2+2NaOH=2NaAlO2+3Ag2O+H2O
C. a电极上的电极反应为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
D. 每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO--)(填“>”、“=”或“<”,下同)。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+) = c(CH3COO--),则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(3)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO--)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为 ( )
A. 0.15 mol/L B. 0.10 mol/L C. 0.25 mol/L D. 0.20 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对①100 mL 0.1 mol/L NaHCO3,②100mL 0.1 mol/L Na2CO3两溶液叙述正确的是( )
A.两溶液中c(OH--):①>②
B.两溶液中阳离子数目:②是①的2倍
C.②溶液中:c(HCO3--)<c(H2CO3)
D.①溶液中:c(CO32-)<c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com