
已知Cl有两种天然同位素35Cl、37Cl,Cl的相对原子质量为35.5,Na只有一种原子23Na,求10吨纯度为90%的食盐(杂质中不含Na、Cl)样品中含37Cl多少吨,含Na35Cl多少吨.
考点:
同位素及其应用.
专题:
原子组成与结构专题.
分析:
元素的相对原子质量为该元素各种核素的相对原子质量的平均值,原子的相对原子质量在数值上等于其质量数,先根据元素的相对原子质量计算3517Cl和3717Cl的原子个数比,再根据原子个数比和质量守恒计算23Na35Cl、23Na37Cl的质量.
解答:
解:氯元素的相对原子质量35.5是质量数分别为35和37的核素的平均值,可以采用十字交叉法计算其原子个数比;
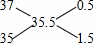 ,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,10吨纯度为90%的食盐中食盐的质量为10吨×90%=9吨,设23Na35Cl、23Na37Cl的质量分别为X、Y吨,则X+Y=9(质量守恒),
,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,10吨纯度为90%的食盐中食盐的质量为10吨×90%=9吨,设23Na35Cl、23Na37Cl的质量分别为X、Y吨,则X+Y=9(质量守恒),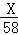 :
: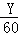 =
=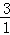 (Cl的原子个数之比),解得:X≈6.692吨,Y≈2.308吨,所以含3717Cl的质量=2.308吨×
(Cl的原子个数之比),解得:X≈6.692吨,Y≈2.308吨,所以含3717Cl的质量=2.308吨×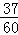 ≈1.423吨;
≈1.423吨;
答:样品中含37Cl1.423吨;含Na35Cl6.692吨;
点评:
本题以计算核素的质量为载体考查了同位素原子个数的计算,题目难度中等,明确元素的相对原子质量为该元素各种核素的相对原子质量的平均值是解本题的关键.


科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是( )
A.利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解
B.向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液,试管口出现红棕色气体,
说明溶液中NO3-被Fe2+还原为NO2
C.将 某气体通入品红溶液中,品红褪色,说明该气体一定是SO2
某气体通入品红溶液中,品红褪色,说明该气体一定是SO2
D.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,
加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表的一部分,按要求完成各小题.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)化学性质最不活泼的元素 ,(填元素编号),非金属性最强的元素是 .金属性最强的单质与水反应的离子方程式为
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的 .(填元素编号)
(3)①③⑤三种元素的原子半径由大到小的顺序为 .(填元素编号)
(4)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素名称为 .向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,反应离子方程式为 .
(5)铜与元素周期表中26号元素的单质作电极材料,三氯化铁溶液为电解质溶液形成原电池,则负极材料为 .正极反应方程式为 ,该原电池总反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究苯和溴的取代反应,甲用如图所示的装置Ⅰ进行如下实验:将一定量的苯与溴放在烧瓶中,同时加入少量铁屑,3~5min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯和溴发生了取代反应.
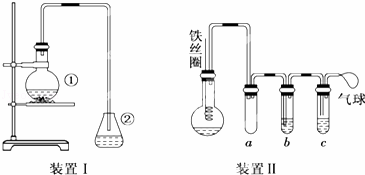
(1)装置I中①的化学方程式为 , .
(2)①中长导管的作用是 .
(3)烧瓶中生成的红褐色油状液滴的成分是 ,要想得到纯净的产物,可用 试剂洗涤.洗涤后分离产品应使用的仪器是 .
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是 .
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.a的作用是 ,b中的试剂是 ,比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)① ;② .
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号).
a.自然界中的含量 b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 .
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.
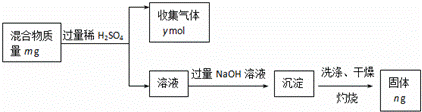
能确定混合物中Y的质量分数的数据有 (填序号).
a.m、n b.m、y c.n、y.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分离方法的叙述中,不正确的是()
A. 用过滤的方法分离氯化钠溶液和牛奶的混合物
B. 用蒸馏的方法将自来水制成蒸馏水
C. 用四氯化碳萃取碘水中的碘
D. 用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙 . (2)分离碘和水的混合物 .
(3)分离水和汽油的混合物 . (4)分离酒精和水的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与材料、生活和环境密切相关.下列有关说法中错误的是()
A. 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C. 大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D. 新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在氧化还原反应中,金属单质只体现还原性,金属阳离子只体现氧化性 |
|
| B. | 能在水溶液或熔融状态下导电的物质是电解质 |
|
| C. | 清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线的散射形成的 |
|
| D. | 在一个氧化还原反应中,有一种素被氧化,必有另一种元素被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com