
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
分析 根据元素在周期表中的位置知,①-(12)分别是N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br元素,
(1)根据以上分析知,①是N元素,⑥是Si元素,⑦是S元素;
(2)在①-(12)元素中,金属性最强的元素位于周期表左下角,非金属性最强的元素位于周期表右上角,最不活泼的元素是稀有气体元素;
(3)元素的非金属性越强,其单质的氧化性越强、其单质与氢气化合越容易、其最高价氧化物的水化物酸性越强、氢化物的稳定性越强.
解答 解:根据元素在周期表中的位置知,①-(12)分别是N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br元素,
(1)根据以上分析知,①是N元素,⑥是Si元素,⑦是S元素,故答案为:N;Si;S;
(2)在①-(12)元素中,金属性最强的元素位于周期表左下角,为K元素,非金属性最强的元素位于周期表右上角为F元素,最不活泼的元素是稀有气体元素为Ar元素,
故答案为:K;F;Ar;
(3)元素的非金属性越强,其单质的氧化性越强、其单质与氢气化合越容易、其最高价氧化物的水化物酸性越强、氢化物的稳定性越强,
元素⑦与元素⑧相比,(用元素符号表示)非金属性较强的是Cl
A.常温下⑦的单质和⑧的单质状态不同与非金属性强弱无关,故错误;
B.⑧的氢化物比⑦的氢化物稳定,说明非金属性Cl>S,故正确;
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应,与金属性强弱无关,故错误;
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强,说明非金属性Cl>S,故正确;
故答案为:Cl;BD.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,熟悉元素周期表结构及元素周期律内涵,知道非金属性强弱判断方法,不能根据得电子多少判断非金属性强弱,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
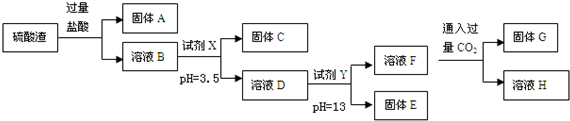
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
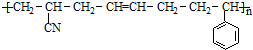 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和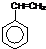 (写结构简式).
(写结构简式).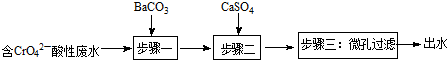
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
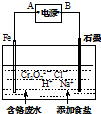
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
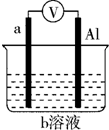 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com