
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
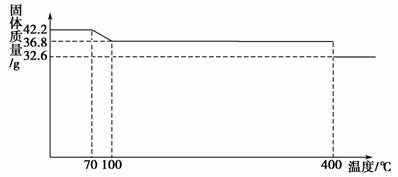
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_________________________________ _____________________________________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____________________________________________________________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为____________________________________________________________。
上述转化的重要意义在于__________________________________ ______________________________________。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全________ _______________________________________________________________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
解析 (1)对于加热失去结晶水的研究,注意开始时质量变化为失去水的质量:
K4[Fe(CN)6]·3H2O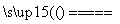 K4[Fe(CN)6]·xH2O+(3-x)H2O
K4[Fe(CN)6]·xH2O+(3-x)H2O
1 3-x
0.1 mol 0.3 mol
x=0
则150 ℃时固体物质的化学式为K4[Fe(CN)6]。
(2)为防止有毒的HCN和KCN生成,应避免与酸性物质接触和控制烹饪温度。
(3)由于KCN+HCl===HCN+KCl,当反应后pH=7,则溶液中有过量的KCN,故a>0.01 mol·L-1
由溶液中电荷守恒得:c(K+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),又因为pH=7,则c(H+)=c(OH-),故c(K+)=c(CN-)+c(Cl-)=0.5a mol·L-1
由物料守恒得:c(K+)=c(CN-)+c(HCN),则c(HCN)=c(Cl-)=0.005 mol·L-1
c(CN-)=(0.5a-0.005)mol·L-1
平衡常数K=c(CN-)·c(H+)/c(HCN)=(0.5a-0.005)×10-7/0.005 mol·L-1。
答案 (1)K4[Fe(CN)6]
(2)避免与醋等酸性物质一起烹饪;控制烹饪温度不超过400 ℃
(3)> (0.5a-0.005)×10-7/0.005 mol·L-1
(4)2Fe3++SO2+2H2O===2Fe2++SO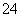 +4H+ 变废为宝,消除污染
+4H+ 变废为宝,消除污染
(5)c(Fe3+)=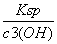 =1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全
=1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全


科目:高中化学 来源: 题型:
针对下面10种元素,完成以下各小题。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(1)地壳中含量最多的元素是___________(填名称)。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)Al的原子结构示意图为___________________。
(4)C与N相比,原子半径较小的是___________。
(5)最高价氧化物对应的水化物碱性最强的是___________(填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是___________。
(7)S和Cl相比,元素非金属性较强的是___________。
(8)可用来制造光导纤维的物质是___________,晶体硅的主要用途是___________(写出一种)。
(9)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
当前环境污染问题越来越严重,如酸雨、温室效应、臭氧层破坏、有毒物质的污染、汽车尾气的污染、水体污染等已成为世界各国普遍关注和研究的问题。
请回答:
(1)引起温酸雨的主要气体是 (填序号,下同)。
①SO2 ②CO2
(2)使臭氧层受到破坏的主要气体是 。
①二氧化碳 ②氟氯代烷
(3)造成居室污染的物质是 。
①CO ②N2
(4)造成水体污染的原因是 。
①生活污水的任意排放 ②工业废水的任意排放
(5)为了治理汽车污染问题,可以在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂)。它特点是使汽车排放出的CO与NO反应,生成CO2和N2,写出该反应的化学方程式: 。
(6)煤的气化可有效地降低大气中污染物的排放,是高效、清洁的利用煤炭的重要途径。一些城市中使用的水煤气是将焦炭与水蒸气在高温下反应得到的,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl
的Ksp=4×10-10,下列说法不正确的是( )
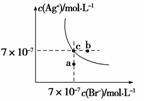
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
 D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4>HBrO4 B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl D.气态氢化物稳定性:HF>H2O>PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)探究一溴环己烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、
乙两位同学分别设计如下两个实验方案:
甲:向反应混合物中滴入稀HNO3中和NaOH,后滴入AgNO3溶液,若有浅黄色沉淀,
则可以证明发生了消去反应。
乙:向反应混合物中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
请评价上述两个方案是否合理,并说明理由。
甲:_________,______________________________________________________。
乙:_________,______________________________________________________。
(2)如图所示为实验室制取少量硝基苯的装置.根据题意完成下列填空:
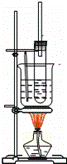 ①写出制取硝基苯的化学方程式
①写出制取硝基苯的化学方程式
②长玻璃导管的作用是
③硝基苯有毒,如果少量的液体溅在皮肤上,应用 擦洗.
A.苯 B.酒精 C.硫酸 D.水.
(3)某实验小组用下列装置进行乙醇催化氧化的实验.
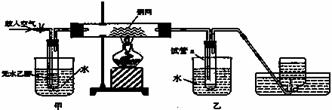
甲和乙两个水浴作用不相同.甲的作用是 ;
乙的作用是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com