
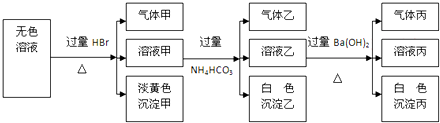


科目:高中化学 来源: 题型:
| A、3g | B、3.2g |
| C、4.4g | D、5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为3NA |
| C、常温常压下,48gO2和O3的混合气中含有的氧原子数为3NA |
| D、1mol/L的NaCl溶液中所含Na+为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
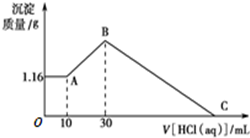 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入氧气的电极为正极 |
| B、参加反应的O2与C2H6的物质的量之比为7:2 |
| C、放电一段时间后,KOH的物质的量浓度将下降 |
| D、放电一段时间后,正极区附近溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com