
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO-)大于同浓度CH3COONa溶液中的c(CH3COO-) |
分析 0.1mol•L-1 CH3COONH4溶液呈中性,说明醋酸根离子与铵根离子的水解程度相同,相同物质的量的醋酸与一水合氨中和生成醋酸铵,醋酸根离子与铵根离子水解相互促进,水的电离程度增大,K(CH3COOH)=$\frac{醋酸水解平衡常数}{{K}_{W}}$,K(NH3•H2O)=$\frac{铵根水解平衡常数}{{K}_{W}}$,据此分析.
解答 解:A、等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到0.05mol•L-1 CH3COONH4溶液,根A错误;
B、醋酸根离子与铵根离子水解相互促进,水的电离程度增大,故B错误;
C、K(CH3COOH)=$\frac{{K}_{w}}{醋酸根的水解平衡常数}$,K(NH3•H2O)=$\frac{{K}_{w}}{铵根的水解平衡常数}$,0.1mol•L-1 CH3COONH4溶液呈中性,说明醋酸根离子与铵根离子的水解程度相同,即醋酸根离子的水解平衡常数=铵根离子的水解平衡常数,水的离子积常数相同,所以K(CH3COOH)=K(NH3•H2O),故C正确;
D、CH3COONa溶液中的c(CH3COO-)自然水解,醋酸铵溶液中醋酸根离子与铵根离子水解相互促进,该溶液中c(CH3COO-)小于同浓度CH3COONa溶液中的c(CH3COO-),故D错误;
故选C.
点评 本题考查了盐类水解的影响因素、电离平衡常数与水解平衡常数以及水的离子积的关系,注意弱酸根离子与弱碱阳离子水解相互促进,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,非金属元素全部都是主族元素 | |
| B. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25g/mol | B. | 27g/mol | C. | 30g/mol | D. | 32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
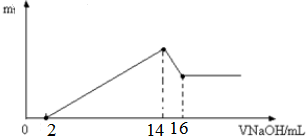
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1mol•L-1 NaCl溶液 | B. | 20mL 2mol•L-1 AlCl3溶液 | ||
| C. | 30mL 1mol•L-1 MgCl2溶液 | D. | 100mL 3mol•L-1 NaClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
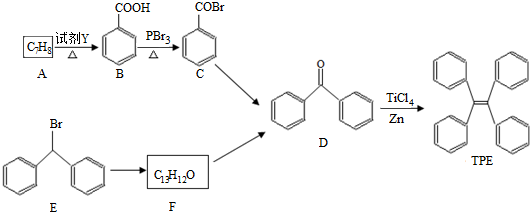
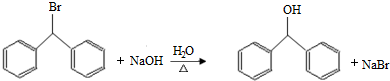 ;
;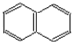 )的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式:
)的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式: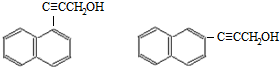 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
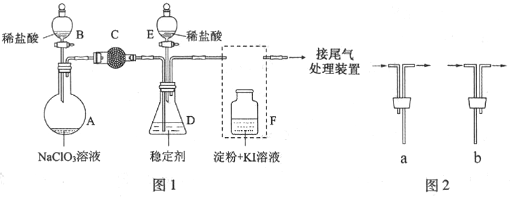
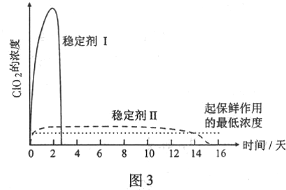
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com