
【题目】三氯氧磷(POCl2)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
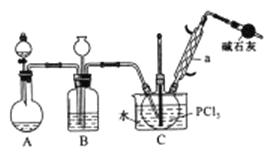
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________。
(2)B装置的作用除观察O2的流速之外。还有__________________________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取xg 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol/L 的AgNO3容液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol/LNH4SCN 溶液滴定过量Ag+至终点,记下所用 体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是________________(填标号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____________________。
③步骤Ⅲ加入硝基苯的目的是_________________,如无此操作,所测Cl元素含量将会____________填“偏大”“ 偏小”或“不变”)。
【答案】 2Na2O2+2H2O=4NaOH+O2↑(或2H2O2![]() 2H2O+O2↑) 平衡气压、干燥O2(或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质) 加快反应速率,同时防止PCl3气化,逸出损失 b
2H2O+O2↑) 平衡气压、干燥O2(或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质) 加快反应速率,同时防止PCl3气化,逸出损失 b ![]() ×100% [或
×100% [或![]() %] 3 防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN溶液偏小
%] 3 防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN溶液偏小
【解析】(1)装置A中应该为不加热条件下制备氧气,故可以利用过氧化钠与水反应或双氧水在二氧化锰催化剂下分解生成氧气,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑(或2H2O2![]() 2H2O+O2↑);(2)B装置的作用除观察O2的流速之外。还有平衡气压、干燥O2或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质;(3)根据图表信息可知,PCl3沸点较低,一旦温度过高,PCl3会大量挥发,从而导致产量降低;但是温度过低,反应速率会变慢,因此C装置要控制反应在60℃~65℃进行;(4)①实验中用NH4Fe(SO4)2溶液滴定过量银离子,当银离子反应完全,溶液中存在SCN-,遇铁离子生成红色配合物溶液颜色为红色,所以用NH4Fe(SO4)2做指示剂,答案选b;②根据反应SCN-+Ag+= AgSCN↓可知,硝酸银溶液中剩余硝酸银的量为,根据反应Cl-+Ag+= AgCl↓可知,与氯离子反应的硝酸银的量为0.1000
2H2O+O2↑);(2)B装置的作用除观察O2的流速之外。还有平衡气压、干燥O2或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质;(3)根据图表信息可知,PCl3沸点较低,一旦温度过高,PCl3会大量挥发,从而导致产量降低;但是温度过低,反应速率会变慢,因此C装置要控制反应在60℃~65℃进行;(4)①实验中用NH4Fe(SO4)2溶液滴定过量银离子,当银离子反应完全,溶液中存在SCN-,遇铁离子生成红色配合物溶液颜色为红色,所以用NH4Fe(SO4)2做指示剂,答案选b;②根据反应SCN-+Ag+= AgSCN↓可知,硝酸银溶液中剩余硝酸银的量为,根据反应Cl-+Ag+= AgCl↓可知,与氯离子反应的硝酸银的量为0.1000![]() 40
40![]() 10-3-cV
10-3-cV![]() 10-3=4
10-3=4![]() 10-3-cV
10-3-cV![]() 10-3mol;Cl元素的质量百分含量为
10-3mol;Cl元素的质量百分含量为![]() ×100%或
×100%或![]() %;③步骤Ⅲ加入硝基苯的目的是防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN;氯化银和AgSCN的Ksp相差不大,在溶液中存在沉淀转化,所以加入有机物覆盖沉淀表面阻断氯化银溶解平衡的转化;若无此操作则第Ⅳ消耗NH4SCN溶液偏高,计算出氯元素含有偏少。
%;③步骤Ⅲ加入硝基苯的目的是防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN;氯化银和AgSCN的Ksp相差不大,在溶液中存在沉淀转化,所以加入有机物覆盖沉淀表面阻断氯化银溶解平衡的转化;若无此操作则第Ⅳ消耗NH4SCN溶液偏高,计算出氯元素含有偏少。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】一碳化学是指以分子中只含一个碳原子的化合物(如一氧化碳、二氧化碳、甲烷、甲醇等)为原料,用化工的方法制造产品的化学体系的总称。我国能源比较丰富,煤的探明储量6000亿吨,居世界第三位,因此,发展一碳化学有着优越的条件和光明的前途。请回答下列有关问题。
(1)已知在一定温度下有如下反应:
I.C(s)+CO2(g)![]() 2CO(g)H1=akJ/mol
2CO(g)H1=akJ/mol
II.CO(g)+H2O(g)![]() H2(g)+CO2(g)△H2=bkJ/mol
H2(g)+CO2(g)△H2=bkJ/mol
III.C(s)+H2O(g)![]() CO(g)+H2(g)△H3________。
CO(g)+H2(g)△H3________。
(2)在一恒容的密闭容器中,加入lmolCO(g)、2molH2O(g),发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:

①该反应的△H__0(填“<”或“>”。)
②在某温度下,能判断该反应是否达到化学平衡状态的依据是________。
a.混合气体中c(CO)不变 b.c(CO)=c(CO2)
c.υ正(H2O)=υ逆(H2) d.混合气体的平均相对分子质量不变
③A点时H2O(g)的转化率为__________。
④在体积不变时,要增大该反应的正反应速率可采取的措施是_______(写两条)。
⑤A点时该反应的平衡常数为________(保留到小数点后两位)。
⑥若在该容器中充入2molCO和3mol水蒸气进行反应,达到平衡时水蒸气的体积分数与H2的体积分数相等,则平衡后CO的体积分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏德罗常数的值,下列叙述正确的是
A.物质的量是一个物理量,它的单位是个
B.常温常压下,11.2 L H2所含的分子数为0.5 NA
C.1 mol 水的质量是18 g
D.MgCl2的摩尔质量为95
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从冬青中提取出的有机物A可用合合成抗结肠炎药物Y及其他化学品,合成路线如图:
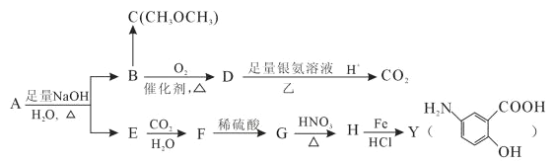
根据上述信息回答:
(1)请写出Y中含氧官能团的名称_________________________。
(2)写出反应③的反应类型:________________________________。
(3)写出反应①的化学方程式:_______________________________________。
(4)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成![]() 和
和![]() ,鉴别I和J的试剂为____________________。
,鉴别I和J的试剂为____________________。
(5)G的同分异构体中,满足下列条件的有_____________种。
①能发生银镜反应 ②能与氯化铁溶液发生显色反应
其中核磁共振氢谱显示四种不同类型的吸收峰。且其峰面积之比为1:2:2:1的结构简 式为____(写一种)。
(6)A的另一种同分异构体K用于合成高分子材料M(![]() ),K 可由L(
),K 可由L(![]() )制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:
)制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:![]() ___________________________
___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
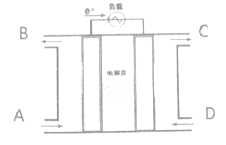
【题目】电解原理在化学工业中有着广泛的应用。现将设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y是两块电板板,则:

(1)若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是________________________。
(2)若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质的电解总反应方程式为:________________,将其露置在空气中可观察到的现象为______。
(3)若X和Y均为情性电板,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2,恰好恢复电解前的浓度,则电解过程中转移的电子的物质的量为______。
(4)某同学为了使反应2HCl+2Ag=2AgC1+H2↑能在上述装置中进行,则电解液及电极分别为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池利用原电池的工作原理将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能:能有效提高能源利用率,具有广泛的应用前景。某种燃料电池的总反应式是:CH4+2O2+2OH-=CO32-+ 3H2O,装置如下图所示,该电池用金属铂片作电极在两极上分别通甲烷和氧气。请思考回答以下问题:
(1)电解质溶液可能是_________________;阳离子的移动方向:___________。(“左→右”、“右→左”)
(2)D气体通入的电池的_________极,发生的电极反应式:__________________;A通入的是______________,发生的电极反应式:_________________。
(3)当该电子流经导线的电子为4mol时,A入口至少需要通入_______L的气体(标准状态下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中必须加入还原剂才能进行的是
A.Fe2+ → Fe3+B.NH3 → NH4+C.SO32-→ SO42-D.MnO4 → Mn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com