
如何洗涤附着在试管内壁上的硫?
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.SO2具有还原性,故可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.氨是氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
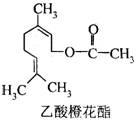
乙酸橙花酯是一种食用香料,其结构简式如下图所示,
关于该有机物的下列叙述中正确的是
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1 mol该有机物水解时只能消耗1 mol NaOH。
⑥1 mol该有机物在一定条件下和H2反应,共消耗H2 为3 mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+ H2O = H2SO3 ; MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。回答下例问题:
(1)步骤②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+ ,将过量的SO2氧化除去,相应反应的离子方程式为 。
(2)查阅表1,步骤③中调pH为3.5时沉淀的主要成分是 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)步骤③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是 。
(6)现有常温下的四种溶液:
①0.1mol·L-1 NH4Cl溶液
②0.1mol·L-1 NH4Cl和0.1mol·L-1 NH3·H2O的混合溶液(显碱性)
③0.1mol·L-1 NH3·H2O
④0.1mol·L-1 NH4Cl和0.1mol·L-1 HCl
下例说法正确的有 (填字母序号)
A. NH4+离子浓度从大到小的顺序为②>④>①>③
B.溶液的pH从大到小的顺序为③>①>②>④
C.溶液中的离子总浓度从大到小的顺序为④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
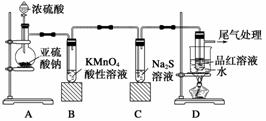
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________________________________________________________________。
(2)实验过程中,装置B、C中发生的现象分别是_______________________________
______________、_______________________________________________________;
这些现象分别说明SO2具有的性质是________________和________________;装置B中发生反应的离子方程式为___________________________________________________
________________________________________________________________________。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
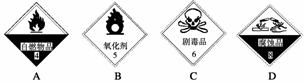
(1)浓硫酸试剂瓶上适合贴上的标签是________(填序号)。
(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:_____________________________________________________________。
实验结论:所得灰白色固体的化学式为__________。
(3)乙还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是(用化学方程式回答)________________________________________________________________________。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是______________________________________。
方法二
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2 2CuO,CuO+H2SO4===CuSO4+H2O。
2CuO,CuO+H2SO4===CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是①_____________________________________;
②________________________________________________________________________。
方法三
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是 ( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2===NH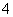 +HCO
+HCO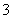
B.少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D.向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO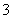 +Ba2++2OH-===BaCO3↓+CO
+Ba2++2OH-===BaCO3↓+CO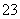 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置能达到实验目的有(夹持仪器未画出) ( )
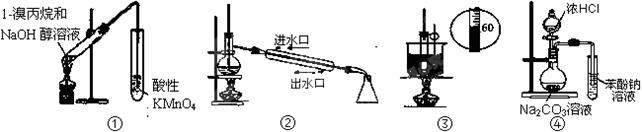
A.①装置用于检验1-溴丙烷消去产物 B.②装置用于石油的分馏
C.③装置用于实验室制硝基苯 D.④装置可证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com