
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水解生成胶体;
B.向Na2S溶液中滴加盐酸,反应生成硫化氢,发生强酸制取弱酸的反应;
C.白色沉淀可能为AgCl;
D.Zn为负极,Cu为正极,正极上氢离子得到电子.
解答 解:A.将饱和FeCl3溶液滴入沸水中,水解生成Fe(OH)3胶体,观察到红褐色液体,故A错误;
B.向Na2S溶液中滴加盐酸,反应生成硫化氢,可知盐酸的酸性比氢硫酸的酸性强,不能比较非金属性,故B错误;
C.向溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀可能为AgCl或硫酸钡,则溶液中可能含银离子或含有SO42-,但二者不能同时存在,故C错误;
D.Zn为负极,Cu为正极,正极上氢离子得到电子生成氢气,观察到铜片上有气泡,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及胶体制备与盐类水解、酸性与非金属性比较、离子检验、原电池等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有共价键的化合物就是共价化合物 | |
| B. | 离子化合物不可能全部由非金属构成 | |
| C. | H2O比H2S的沸点高是由于H2O中的O-H键更牢固 | |
| D. | 寻找半导体材料可以在元素周期表的金属与非金属的分界线附近寻找 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
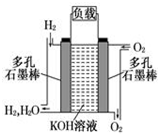 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
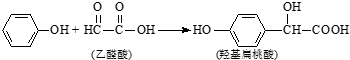
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1mol Br2反应 | |
| C. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 | |
| D. | 羟基扁桃酸可以发生取代、氧化、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共包含18种元素 | B. | 前3周期元素 | ||
| C. | 除稀有气体外,Cl的原子半径最大 | D. | 仅含5种金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
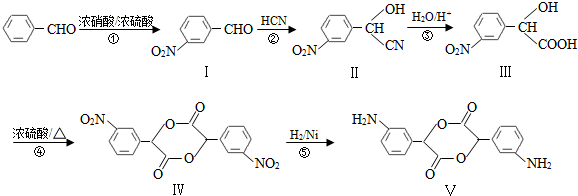
 ,和
,和 .
.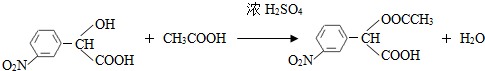 (要求写出反应条件),
(要求写出反应条件),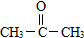 )代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为
)代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为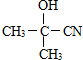 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、羊毛、病毒等主要成分都是蛋白质 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水,也不溶解 | |
| C. | 重金属盐能使蛋白质凝结 | |
| D. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com