
把4.6g钠放入200mL 0.1mol/L的AlCl3溶液中,待其充分反应后,下列叙述中错误的是()
| A. | Cl﹣的浓度几乎不变 | |
| B. | 溶液呈浑浊 | |
| C. | 溶液中几乎不存在Al3+ | |
| D. | 溶液中存在最多的离子是Na+ |
| 钠的化学性质;镁、铝的重要化合物. | |
| 专题: | 元素及其化合物. |
| 分析: | 钠与水发生反应2Na+2H2O=2NaOH+H2↑,计算生成的氢氧化钠,再根据氢氧化钠与氯化铝的物质的量判断Al3+与OH﹣发生的反应,结合选项判断; |
| 解答: | 解:4.6g钠的物质的量为 A、参加反应的水很小,溶液的体积变化不大,氯离子不反应,Cl﹣的浓度几乎不变,故A正确; B、Al3+与OH﹣发生反应Al3++4OH﹣=AlO2﹣+2H2O,OH﹣有剩余,溶液澄清,故B错误; C、Al3+与OH﹣发生反应 D、溶液中Na+为0.2mol,氯离子为0.06mol,偏铝酸根为0.02mol,氢氧根为0.2mol﹣0.02mol×4=0.12mol,溶液中存在最多的离子是Na+,故D正确; 故选B. |
| 点评: | 本题考查钠铝及其化合物的性质、化学计算等,判断氢氧化钠与氯化铝的反应是解题关键,题目难度中等. |


科目:高中化学 来源: 题型:
下列各组物质不属于同分异构体的是( )
A.2,2二甲基丙醇和2甲基丁醇
B.邻氯甲苯和对氯甲苯
C.2甲基丁烷和戊烷
D.甲基丙烯酸和甲酸丙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨的反应是在500℃左右进行的,这主要是因为( )
A.500℃时此反应速率最快
B.500℃时NH3的平衡浓度最大
C.500℃时N2的转化率最高
D.500℃时该反应的催化剂活性最大
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用.下列说法中不正确的是()
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| C. | 用Al(OH)3制胃酸过多 | |
| D. | 电解AlCl3饱和溶液,可制得金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为()
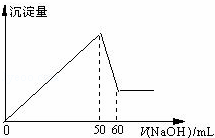
| A. | 6:1 | B. | 3:1 | C. | 2:1 | D. | 1:2 | |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g,称取时使用的仪器名称为托盘天平.
(2)将样品溶于足量稀盐酸中,过滤,滤渣中含有;在溶解过滤时使用的主要仪器有
(3)往滤液中加入过量溶液,过滤,写出该步操作中有关的化学方程式:.
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g.有关反应的化学方程式为:.
(5)计算该样品中铝的质量分数的表达×100%.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组材料中,能组成原电池的是
| A | B | C | D | |
| 两极材料 | 石墨、石墨 | Zn片、Cu片 | Zn片、Cu片 | 石墨、Cu片 |
| 插入溶液 | H2SO4溶液 | 乙醇溶液 | 稀盐酸 | H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑨在表中的 位置,用化学用语回答下列问题:
位置,用化学用语回答下列问题:
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 |
| ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑧元素氢化物的电子式是 。
(2)②、③、⑤元素的原子半径由大到小的顺序为____________________。
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是_________________________。
(4)有两种化合物A和B都由①④⑤⑧四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为  。
。
(5 )上述元素中最高价氧化物对应的水化物的酸性最强的是
)上述元素中最高价氧化物对应的水化物的酸性最强的是
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2 2SO3,下列叙述能够说明反应已经达到平衡状态的是
2SO3,下列叙述能够说明反应已经达到平衡状态的是
A. 容器中SO2、O2、SO3共存 B. SO2与SO3的浓度相等
C. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2 D. 反应容器中压强不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com