
 反应中,H2O是氧化剂.
反应中,H2O是氧化剂.分析 (1)两种元素组成其中一种是氧元素的化合物为氧化物;和碱反应生成盐和水的氧化物为酸性氧化物,和碱发生的反应为复分解反应;水溶液中电离出的阳离子全部是氢离子的化合物为酸;
(2)次氯酸钙属于溶于水的盐,是强电解质在水中溶解完全电离;
(3)氧化还原反应的实质是电子转移,化合价降低元素所在的反应物是氧化剂,发生还原反应,元素失去电子化合价升高,化合价升高数=化合价降低数=转移电子数;
(4)Na与H2O反应生成氢氧化钠和氢气,依据标准状况下气体体积金属气体物质的量,n=$\frac{V}{22.4}$,结合星峰传说金属溶液中溶质物质的量,溶质浓度c=$\frac{n}{V}$;
解答 解:(1)①Na ②Cl2 ③Ca(ClO)2 ④Fe2O3 ⑤次氯酸 ⑥Al(OH)3 ⑦Na2O ⑧SiO2
属于金属氧化物的是 ④Fe2O3,⑦Na2O,属于酸性氧化物的是 ⑧SiO2 ,属于酸的是⑤次氯酸,①Na ②Cl2是单质,③Ca(ClO)2 是盐,⑥Al(OH)3 是碱,
故答案为:④⑦,⑧,⑤;
(2)次氯酸钙属于溶于水的盐,是强电解质,Ca(ClO)2 在水中溶解完全电离,电离方程式为:Ca(ClO)2=Ca2++2ClO-,
故答案为:Ca(ClO)2=Ca2++2ClO-;
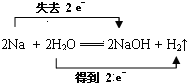
(3)Na与H2O反应的化学方程式:2Na+2H2O=2NaOH+H2↑,钠元素化合价0价变化为+1价失电子做还原剂被氧化,氢元素化合价+1价变化为0价,H2O做氧化剂被还原,电子转移总数为2e-,在化学方程式上标注失电子和得到电子的转移总数,用“双线桥”标出反应中电子转移的方向和数目为: ,
,
故答案为: ,H2O;
,H2O;
(4)一定量的Na与H2O反应后,2Na+2H2O=2NaOH+H2↑,若生成标准状况下的气体体积为2.24L,氢气物质的量n=$\frac{2.24L}{22.4L/mol}$=0.1mol,则反应生成氢氧化钠物质的量为0.2mol,反应后的溶液体积为200mL,则溶液中溶质的物质的量浓度=$\frac{0.2mol}{0.2L}$=1mol/L,
故答案为:1 mol/L;
点评 本题考查物质分类,物质的量浓度和化学方程式的计算应用,氧化还原反应中的基本概念知识,要求学生熟记教材知识,灵活应用,题目较简单.


科目:高中化学 来源: 题型:选择题
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)>v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学实验现象 | 解释与结论 | |
| A | 钠与水反应时浮在水面上 | 钠与水生成的气体托举钠浮在水面上 |
| B | 铁与氯气反应剧烈燃烧产生红棕色的烟 | 产物为红棕色小颗粒,燃烧不一定需要氧气 |
| C | 氯水呈黄绿色 | 氯气与水反应生成了黄绿色物质 |
| D | 氢气在氯气中燃烧时瓶口有白雾 | 氯气逸出结合空气中的水蒸气而呈白雾状 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在丙烯醛分子中,仅含有一种官能团 | |
| B. | 丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯醛能发生加聚反应,生成高聚物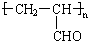 | |
| D. | 等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | 某物质灼烧时,焰色反应呈现黄色,一定不含钾元素 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究温度对产率的影响 实验②和③探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | 4:1 | |
| ④ | 398 | 4 | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com