
| A. | CH4 | B. | PCl3 | C. | SiCl4 | D. | XeF4 |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构.
解答 解:A.CH4分子C原子的价层电子对个数=4+$\frac{1}{2}$(4-1×4)=4,属于sp3杂化,其VSEPR模型为正四面体,该分子中没有孤电子对,所以其空间构型为正四面体;分子中H原子只有2个电子,不满足8电子稳定结构,故A错误;
B.PCl3分子P原子的价层电子对个数=3+$\frac{1}{2}$(5-1×3)=4,属于sp3杂化,其VSEPR模型为正四面体,该分子中一个孤电子对,所以其空间构型为三角锥;分子中P原子和Cl原子均满足8电子稳定结构,故B错误;
C.SiCl4分子Si原子的价层电子对个数=4+$\frac{1}{2}$(4-1×4)=4,属于sp3杂化,其VSEPR模型为正四面体,该分子中没有孤电子对,所以其空间构型为正四面体;分子中Si原子和Cl原子均满足8电子稳定结构,故C正确;
D.XeF4分子Xe原子的价层电子对个数=4+$\frac{1}{2}$(8-1×4)=6,属于sp3d2杂化,其VSEPR模型为正八面体,该分子中2个孤电子对,所以其空间构型为平面正方向;分子中Xe原子不满足8电子稳定结构,故D错误.
故选C.
点评 本题考查了微粒空间构型的判断和8电子结构判断,注意分子中含有氢元素,该分子一定不满足各原子达8电子结构,注意把握杂化轨道理论及其应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是制造太阳能电池的常用材料 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 氢氟酸可用刻蚀玻璃 | |
| D. | 硅是制取水泥的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
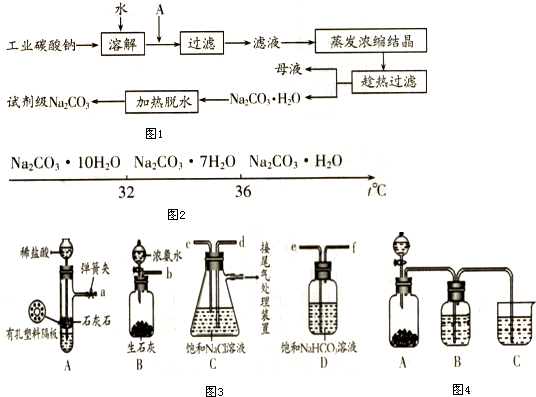
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )| A. | EGCG能与碳酸钠溶液反应放出二氧化碳 | |
| B. | EGCG遇FeCl3溶液能发生显色反应 | |
| C. | 1molEGCG最多可与含10mol NaOH的溶液完全作用 | |
| D. | EGCG在空气中易氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Na>Mg>Al | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在O2中 | B. | 仅在NO2中 | C. | 仅在O2和NO2中 | D. | 平衡体系中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ①②③ | C. | ③⑤⑥ | D. | ①⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com