
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
分析 (1)根据影响反应速率的因素有浓度、压强、温度和催化剂的比表面积,而要想探究一种影响因素,必须保持其他影响因素是一致的来分析;
(2)根据第Ⅰ组实验中,达平衡时CO的平衡浓度为1.00×10-3mol/L,可得出CO的浓度该变量,再根据在一个反应中,各物质的浓度的该变量之比等于计量数之比即可求出NO的浓度的该变量,从而求出NO的平衡浓度;
(3)由图象可知,增大催化剂比表面积后,缩短了到达平衡的时间,故增大了反应速率.
解答 解:(Ⅰ)(1)探究一种影响因素,必须保持其他影响因素是一致,通过对比Ⅱ和Ⅰ的条件可知,两者的区别是催化剂的比表面积不同,故其他的影响因素均应相同,故Ⅱ中温度为280T,NO初始浓度为6.50×10-3mol/L,CO初始浓度为4.00×10-3mol/L,而且Ⅱ探究的是催化剂比表面积对尾气转化速率的影响,
故答案为:
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | ||||
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 6.50×10-3 | 4.00×10-3 | |
| Ⅲ |
点评 本题考查了影响反应速率的因素,题目难度中等,注意掌握影响化学反应速率的因素,明确设计对照试验原则:要探究一种影响因素,必须保持其他影响因素完全相同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
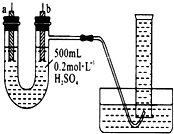 给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
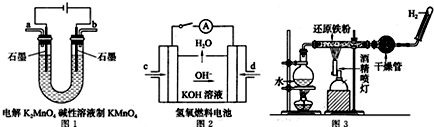
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极是Ag2O,负极是Zn | |
| B. | 该电池负极的电极反应式为:Zn+2OH--2e-═ZnO+H2O | |
| C. | 理论上该电池工作一段时间后,溶液中KOH的浓度不变 | |
| D. | 该电池工作时,电解质中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A、探究不同催化剂对同一反应速率的影响 | B、探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 | 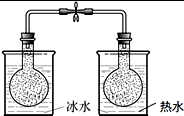 2NO2(g)?N2O4△H<0 试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C、探究醋酸、碳酸、硼酸的酸性强弱 | D、验证外加电流的阴极保护法 |
 试剂:0.1mol/L醋酸溶液、饱和硼酸 溶液0.1mol/L Na2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 | 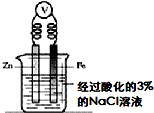 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
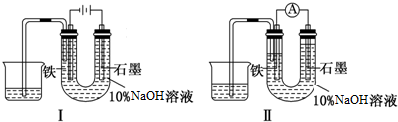
| A. | 装置I中石墨电极处得到气体的体积比铁电极处得到气体的体积大 | |
| B. | 用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2↓ | |
| C. | 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-═H2↑ | |
| D. | 装置I通电10分钟后,溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
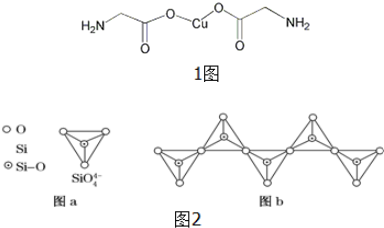
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
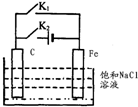
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com