
| A. | 各元素在元素周期表中的族序数:W=X>Y>Z | |
| B. | 最高价氧化物对应的水化物的酸性:W>Z | |
| C. | 离子半径:X>Y>Z | |
| D. | YW3不能与NaOH溶液反应 |
分析 X、Y、Z、W均为短周期主族元素且原子序数依次增大,其中X的气态氢化物的水溶液能够蚀刻玻璃,则X为F元素;Y3+的硫酸盐水溶液显酸性,则Y为Al;含Z2-的钠盐水溶液显碱性,则Z为S元素,可推知W为Cl.
A.主族族序数等于最外层电子数;
B.元素非金属性越强,最高价氧化物对应水化物的酸性越强;
C.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
D.氯化铝与氢氧化钠反应生成氢氧化铝沉淀或偏铝酸钠.
解答 解:X、Y、Z、W均为短周期主族元素且原子序数依次增大,其中X的气态氢化物的水溶液能够蚀刻玻璃,则X为F元素;Y3+的硫酸盐水溶液显酸性,则Y为Al;含Z2-的钠盐水溶液显碱性,则Z为S元素,可推知W为Cl.
A.主族族序数等于最外层电子数,各元素在元素周期表中的族序数:Cl=F>S>Al,故A错误;
B.同周期自左而右元素非金属性增强,元素非金属性越强,最高价氧化物对应水化物的酸性越强,高氯酸的酸性比硫酸的强,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径S2->F->Al3,故C错误;
D.氯化铝与少量的氢氧化钠反应生成氢氧化铝沉淀与氯化钠,与过量的氢氧化钠反应生成偏铝酸钠与氯化钠,故D错误.
故选:B.
点评 本题考查结构性质位置关系应用,熟练掌握元素化合物知识,注意对元素周期律的理解,掌握微粒半径比较规律.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
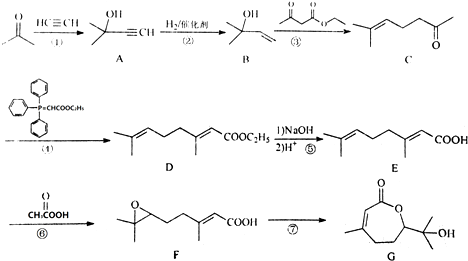
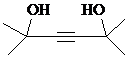 .
. ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
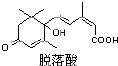 脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )
脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )| A. | 脱落酸的化学式C15H18O4 | |
| B. | 脱落酸只能和醇类发生酯化反应 | |
| C. | 1 mol 脱落酸最多可以和2 mol 金属钠发生反应 | |
| D. | 1 mol 脱落酸最多可以和2 mol 氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D是非金属性最强的元素 | |
| B. | B的单质有多种同分异构体,其中一种是自然界中最坚硬的物质 | |
| C. | B的氢化物的稳定性大于D的氢化物 | |
| D. | A与C只能够形成两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
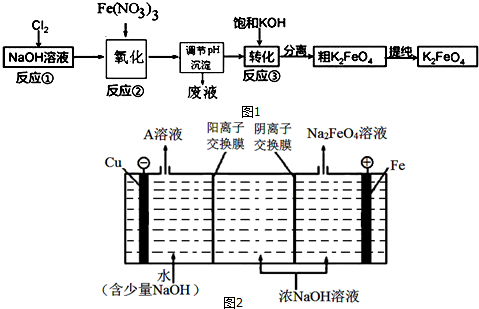
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
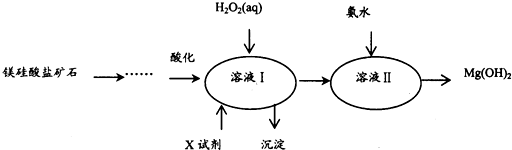
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
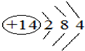 .
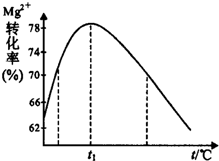
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的物质的量浓度 | B. | 混合气体的压强 | ||
| C. | 混合气体总物质的量 | D. | v(C)与v(D)的比值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com