
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:

已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
【答案】 C MnO2+H2O2+2H+=Mn2++O2↑+2H2O 2MnCO3+O2![]() 2MnO2+2CO2 除去溶液中的Fe3+杂质 Fe2+与Zn2+不能分离[或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全] MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O
2MnO2+2CO2 除去溶液中的Fe3+杂质 Fe2+与Zn2+不能分离[或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全] MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O ![]() ×100%
×100%
【解析】试题分析:本题通过对“利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺”探讨,主要考查除杂操作、反应方程式和离子方程式书写、沉淀的方法、中和滴定计算等基础知识,考查考生综合运用溶度积常数的能力、滴定实验的分析能力和对未知反应的判断书写能力。
解析:(1)炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等,所以除去碳粉可以采用焙炒的方法,焙烧时,炭包内部的碳比较难与氧气反应除去,正确答案:C。(2)已知中粗MnO2在硫酸、H2O2作用下生成MnSO4,既MnO2+H2O2→MnSO4,反应过程中MnO2被还原,则H2O2被氧化生成O2,配平该反应为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O。正确答案:MnO2+H2O2+2H+=Mn2++O2↑+2H2O。(3)上述生成的MnSO4加入Na2CO3后“沉锰”生成MnCO3沉淀,焙烧后生成MnO2,既MnCO3→MnO2,Mn元素被氧化,所以空气中O2作为氧化剂参加了该反应,配平该反应为:2MnCO3+O2![]() 2MnO2+2CO2。正确答案::2MnCO3+O2
2MnO2+2CO2。正确答案::2MnCO3+O2![]() 2MnO2+2CO2。(4)锌皮的主要成分为Zn,含有少量Fe,所以加入硫酸溶解并用H2O2氧化后,溶液中主要存在ZnSO4、Fe2(SO4)3、H2SO4,因此加入的ZnO与H2SO4反应使溶液酸性减弱,从而使Fe3+生成Fe(OH)3沉淀除去。已知Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38,由于Zn(OH)2与Fe(OH)2的溶度积相差不大,所以沉淀Fe2+时Zn2+必然同时生成沉淀。若溶解时不加H2O2,溶液中主要存在ZnSO4、FeSO4、H2SO4,因此用ZnO反应过量H2SO4调节溶液pH使Fe2+沉淀时,Zn2+必然同时生成Zn(OH)2沉淀。正确答案:除去溶液中的Fe3+、Fe2+与Zn2+不能分离(或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全)。(5)纯度测定前半段,MnO2氧化Na2C2O4生成Mn2+和CO2,既MnO2+C2O42-→Mn2++CO2↑,配平该反应得MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O。剩余的Na2C2O4被KMnO4氧化生成Mn2+和CO2,既MnO4-+C2O42-→Mn2++CO2↑,配平得2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O。则根据氧化还原反应电子守恒得
2MnO2+2CO2。(4)锌皮的主要成分为Zn,含有少量Fe,所以加入硫酸溶解并用H2O2氧化后,溶液中主要存在ZnSO4、Fe2(SO4)3、H2SO4,因此加入的ZnO与H2SO4反应使溶液酸性减弱,从而使Fe3+生成Fe(OH)3沉淀除去。已知Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38,由于Zn(OH)2与Fe(OH)2的溶度积相差不大,所以沉淀Fe2+时Zn2+必然同时生成沉淀。若溶解时不加H2O2,溶液中主要存在ZnSO4、FeSO4、H2SO4,因此用ZnO反应过量H2SO4调节溶液pH使Fe2+沉淀时,Zn2+必然同时生成Zn(OH)2沉淀。正确答案:除去溶液中的Fe3+、Fe2+与Zn2+不能分离(或当Fe(OH)2沉淀完全时,Zn(OH)2也沉淀完全)。(5)纯度测定前半段,MnO2氧化Na2C2O4生成Mn2+和CO2,既MnO2+C2O42-→Mn2++CO2↑,配平该反应得MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O。剩余的Na2C2O4被KMnO4氧化生成Mn2+和CO2,既MnO4-+C2O42-→Mn2++CO2↑,配平得2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O。则根据氧化还原反应电子守恒得![]() ,
,![]() ,
, 。正确答案:MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O、
。正确答案:MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O、![]() 。
。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】(1)氨气是重要的化工原料,主要用作化肥、冷冻剂等。现向一固定容积的反应器中通入2molN2和6molH2在催化剂作用下加热至平衡状态,测得此时容器内压强比反应前减小了![]() ,列式计算H2的平衡转化率___。
,列式计算H2的平衡转化率___。
(2)燃料的燃烧将化学能转化成热能,提供了人类生存和发展所需要的能量和动力。现将标况下8.96L乙烷和乙烯的混合气体和足量氧气充分混合并点燃,燃烧产物经过浓硫酸充分吸收后增重16.2g,则混合气体中乙烷和乙烯的物质的量之比为多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+![]() O2(g)→4CO2(g)+5H2O(g)的△H为( )
O2(g)→4CO2(g)+5H2O(g)的△H为( )
A. +2590.4kJ/mol B. ﹣2590.4kJ/mol C. +1295.2kJ/mol D. ﹣1295.2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是_____(填标号)。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为_________。
(3)过程③中,需加入的物质是__________。
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2. 800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3. 495 g。若该聚铁主要成分为[Fe(OH) (SO4)]n,则该聚铁样品中铁元素的质量分数为____________(假设杂质中不含铁元素和硫元素)。
(5)如图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数比为1∶1的具有漂白性的物质,工业上常用电解饱和YZ溶液来获得Z的单质及其他产品。下列说法正确的是
A. W和X、Y、Z均能形成18电子的分子
B. 上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W)
C. X、Y之间形成的化合物可能同时含有离子键和非极性共价健
D. W、X、Z三种元素形成的化合物一定是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,MnO4- 被还原为Mn2+,该反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到__________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②_______________________________。
(4)如果缺少乙装置,可能发生的副反应的化学方程式为___________________;己装置的作用是_________________:
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
A. H2O2溶液 B. FeCl3溶液(滴有KSCN) C. AgNO3溶液 D. 溴水
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38gSnCl4,则SnCl4的产率为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验或操作的叙述正确的是
A. 检验溴乙烷与NaOH水溶液共热产生的乙烯
检验溴乙烷与NaOH水溶液共热产生的乙烯
B.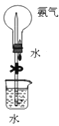 做喷泉实验时先挤压胶头滴管,后松开止水夹
做喷泉实验时先挤压胶头滴管,后松开止水夹
C.酸碱中和滴定前,滴定管和锥形瓶在用蒸馏水洗涤后均需用待装溶液润洗
D.用托盘天平称取1.06g无水碳酸钠,溶于250mL水,配制0.04molL-1 Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图有机物的正确命名为 ( )

A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成具有美白作用的化妆品原料Z的反应原理如下:

下列叙述不正确的是( )
A.X、Z均能与Na2CO3 溶液反应
B.X可作缩聚反应单体,Y可作加聚反应单体
C.X、Y、Z 均能使溴水褪色,但是原理不完全相同
D.该反应的反应类型为取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com