

分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,过滤需要的仪器为漏斗、烧杯、玻璃棒,
故答案为:过滤;玻璃棒、漏斗;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
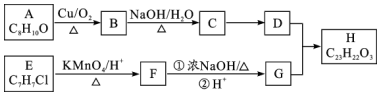
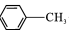 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$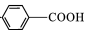
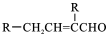
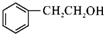 ,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为
,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为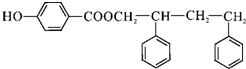 ;
; ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:
已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.
;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | ||
| b | ||
| c |
| A. | 氯、氟、硫 | B. | 氟、硫、砷 | C. | 氦、氟、氯 | D. | 氖、氯、硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,乙物质中含有的化学键是离子键、共价键;
,乙物质中含有的化学键是离子键、共价键; ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
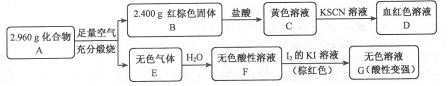
 .写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.
.写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
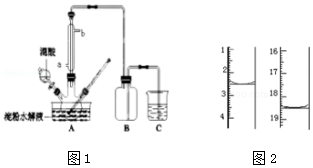
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com