某校化学兴趣小组的同学为探究Fe(NO
3)
2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO
32NaNO
2+O
2↑;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO
2和O
2,如:2Cu(NO
3)
22CuO+4NO
2↑+O
2↑;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO
2和O
2,如:2AgNO
32Ag+2NO
2↑+O
2↑.
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO
3)
2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO
3)
2热分解固体产物溶于足量的稀H
2SO
4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显
价;
猜想三:Fe元素
.
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入
溶液.
(3)实验现象:实验①
;实验②溶液不褪色.
(4)实验结论:猜想二成立,Fe(NO
3)
2分解的化学方程式是
.
【实验二】探究Fe(NO
3)
2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):
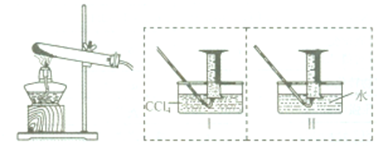
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO
3)
2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用工装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是
.
(2)丙同学取等质量的Fe(NO
3)
2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到
mL气体.
【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO
3、Cu(NO
3)
2、Fe(NO
3)
2的混合粉末充分加热后用排水法未收集到任何气体,则KNO
3、Cu(NO
3)
2、Fe(NO
3)
2的物质的量之比可能是
(填字母序号).
A.1:2:3 B.2:1:3 C.l:2:2 D.3:8:5
(2)若取按上述比例混合的固体硝酸盐1mol溶于100mL 3mol?L
-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为
g.

 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案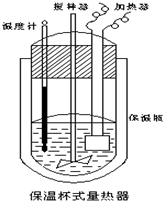 在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.
在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.