
【题目】下列对于“摩尔”的说法和理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1 mol
D.摩尔是物质的量的单位,简称摩,符号为mol
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关用惰性电极电解AgNO3溶液一段时间后的说法正确的是
A. 电解后两极产生的气体体积比为2∶1
B. 电解过程中溶液的pH不断升高
C. 此时向溶液中加入适量的Ag2CO3固体可使溶液恢复电解前的状况
D. 电解过程中阴极质量不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
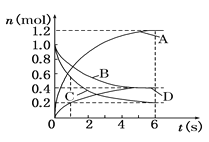
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+3H2(g)=2NH3(g),有关物质的化学键键能(拆开1 mol化学键所需要的能量)如下:
化学键 | N≡N | N—H | H—H |
键能(kJ/mol) | 945.0 | 391.0 | 436.0 |
计算该反应生成2 mol NH3时吸收或放出的热量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
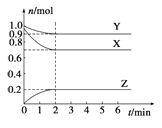
(1)该反应的化学方程式为_______________。
(2)反应开始至2min,气体Z的反应速率为_____________。
(3)若X、Y、Z均为气体,反应达平衡时:①压强是开始时的_______倍;②若此时将容器的体积缩小为原来的0.5倍,达平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2(g)+3H2(g) ![]() 2NH3(g),500 ℃时在容积为10 L的密闭容器中进行,开始时加入1 mol N2和6 mol H2,则达到平衡时,NH3的浓度不可能达到( )
2NH3(g),500 ℃时在容积为10 L的密闭容器中进行,开始时加入1 mol N2和6 mol H2,则达到平衡时,NH3的浓度不可能达到( )
A. 0.1 mol·L-1 B. 0.2 mol·L-1
C. 0.05 mol·L-1 D. 0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。若向1L1mol·L-1的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,则上述过程中放出的热量等于57.3kJ的是( )
A.①B.②C.③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co) < I4(Fe),其原因是______________________________;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是___________________________________________________.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是___________________________________________________________________ 。
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图像所示变为的原因是_______ 。

(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com