
| A. | 金属Cu的晶体的配位数为12 | |
| B. | 金属键是金属阳离子与自由电子间的相互作用 | |
| C. | 金属的延展性可以用电子气理论解释 | |
| D. | 金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68% |
分析 A.金属Cu的晶体为面心立方最密堆积;
B.金属键是金属阳离子和自由电子间的相互作用;
C.“电子气理论”把金属键描述为金属原子脱落下来的价电子形成遍布整快晶体的“电子气”,被所有原子所共有,从而把所有金属原子维系在一起;当金属晶体受到外力作用时,金属正离子间滑动而不断裂;
D.简单立方堆积、配位数6、空间利用率52%;体心立方堆积、配位数8、空间利用率68%;六方最密堆积、配位数12、空间利用率74%;面心立方最密堆积、配位数12、空间利用率74%.
解答 解:A.金属Cu的晶体为面心立方最密堆积,配位数最大,配位数为12,故A正确;
B.金属键是存在于金属阳离子和“自由电子”之间的强的相互作用,这些“自由电子”为所有阳离子所共用,其本质也是电性作用,故B正确;
C.金属发生形变时,自由电子仍然可以在金属子离子之间流动,使金属不会断裂,所以能用电子气理论解释金属的延展性,故C正确;
D.金属Mg、Zn、Ti都是六方最密堆积,空间利用率74%,故D错误;
故选D.
点评 本题考查金属键、金属原子的堆积模式以及金属晶体结构与性质的关系,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,准确理解概念,难度不大.


科目:高中化学 来源: 题型:选择题
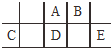 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )| A. | A有5种正价,与B可形成6种化合物 | |
| B. | 工业上常通过电解熔融态C2B3的方法来获得C的单质 | |
| C. | 简单离子的半径由大到小为:E>A>B>C | |
| D. | D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
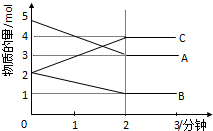 某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:
某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com