
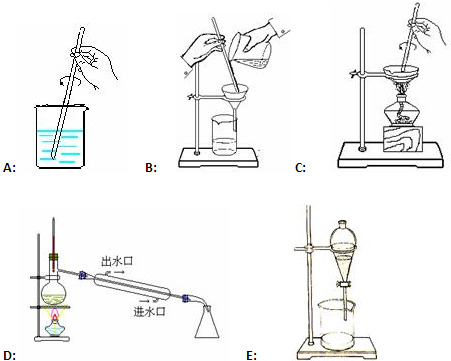


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
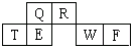 短周期元素Q、R、T、E、W、F在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.
短周期元素Q、R、T、E、W、F在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
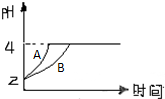 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
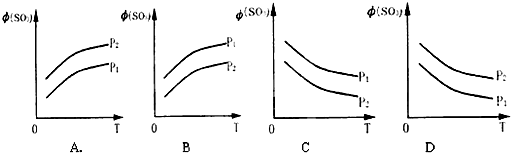
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com