
| A. | HS-+H2O?S2-+H3O+ | B. | SO3+H2O?HSO4-+H3O+ | ||
| C. | HCO3-+H2O?CO32-+H3O+ | D. | NH4++2H2O?NH3•H2O+H3O+ |
科目:高中化学 来源: 题型:解答题
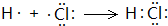 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3COOH+BaCO3→(CH3COO)2Ba+CO2↑+H2O | |
| B. | CH3COOH+KHCO3→CH3COOK+CO2↑+H2O | |
| C. | 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O | |
| D. | CH3COOH+Na2CO3→CH3COONa+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
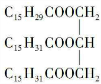 或
或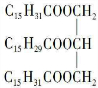 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
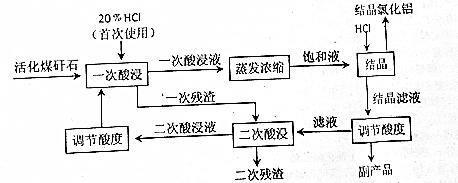
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com