
【题目】铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______。
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________;氮元素的第一电离能呈现异常的原因是____。
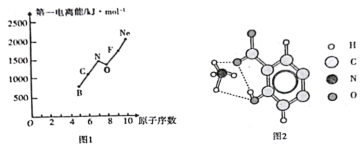
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________,不同之处为_________。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________、____________。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________(NA表示阿伏加德罗常数的值)。
【答案】 从左到右原子半径减小,元素金属性减弱,失电子能力减弱 氮原子的2p轨道为半充满状态,具有稳定性,不易失去电子 AB C 9
从左到右原子半径减小,元素金属性减弱,失电子能力减弱 氮原子的2p轨道为半充满状态,具有稳定性,不易失去电子 AB C 9 ![]() (NH4+)N-H---O(OH) (OH)O-H---O(COO-)
(NH4+)N-H---O(OH) (OH)O-H---O(COO-) ![]()
【解析】
(1)碳原子电子排布式为1s22s22p2,其价层电子的电子排布图为 。
。
(2)元素的第一电离能是气态电中性基态原子失去一个电子变为气态基态正离子时需要的最低能量。失去电子越难,第一电离能越大。同一周期元素从左到右,原子半径逐渐减小,原子核对核外电子的束缚力逐渐增强,失去电子越来越难,所以元素的第一电离能逐渐增大。但氮元素的2p轨道上有3个电子,是比较稳定的半充满结构,所以失去一个电子比较困难,所以其第一电离能比氧大。
(3)①从结构角度分析, NH4+与氨分子的中心原子N原子的价层电子对数均为4,均为sp3杂化,但NH4+是正四面体,而NH3为三角锥形,故相同之处选AB,不同之处选C。
②(NH4)3C19H8(OH)3(COO)3中有羟基和酯基,每个羟基的氧原子都和碳原子结合形成C—Oσ键,每个酯基中有2个C—Oσ键,所以1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为3+3×2=9个。苯环上的碳原子是sp2杂化,每个碳原子还剩一个p轨道上的电子形成大π键,参与形成大π键的原子数为6,参与形成大π键的电子数也为6,则阿罗明拿中苯环的大π键应表示为![]() 。
。
③从图2可以看出,氢键存在于NH4+中的H和COO-的氧原子之间,其表示式为(NH4+)N-H---O(COO-),还存在于NH4+中的H和羟基的O之间,表示式为(NH4+)N-H---O(OH),还存在于羟基中的H和COO-的氧原子之间,其表示式为(OH)O-H---O(COO-)。
(4)立方晶胞参数为a nm,所以晶胞的体积为(a×10-7)3cm3,阿罗明拿的晶体密度为d g·cm-3,所以一个晶胞的质量为(a×10-7)3dg。根据其晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则一个晶胞的质量为![]() g,所以(a×10-7)3d =
g,所以(a×10-7)3d =![]() ,y=
,y=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
C.常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。2017年5月9日,中国公布113号、115号、117号和118号四种元素的中文名称。其中118号元素的原子符号为![]() Og,中文名称为“
Og,中文名称为“![]() ”下列说法不正确的是
”下列说法不正确的是
A. 质子数为118B. 中子数为176
C. 核外电子数为118D. 质量数为412
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型PAA(![]() )具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:

下列说法不正确的是( )
A. 线型PAA的单体不存在顺反异构现象
B. 交联剂a的结构简式是![]()
C. 形成网状结构的过程发生了加聚反应
D. PAA的高吸水性与—COONa有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)在①苯 ②乙醇③甲苯 ④氯乙烷 ⑤![]() ⑥
⑥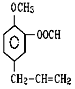 ⑦
⑦![]() 七种物质中(填编号)
七种物质中(填编号)
能和金属钠反应放出H2的有_________________常温能与NaOH溶液反应的有___________
常温下能与溴水反应的有____________________能使酸性KMnO4溶液褪色的有__________
(2)某有机物结构简式如图所示,则用足量的Na、NaOH、NaHCO3、浓溴水分别与等物质的量的该有机物反应时,消耗Na、NaOH、NaHCO3和Br2的物质的量之比为__________.

(3)A、B、C 三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2:6:3,则A、B、C 三种醇分子中含羟基数目之比是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、 (y)、
(y)、![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. y的二氯代物有3种 B. x、y和z均能与溴水发生反应
C. z中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )

A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度有利于该反应平衡正向移动
B. 达到化学平衡时,v正(A2)=2v逆(B2)
C. 升高温度,正向反应速率增加,逆向反应速率减小
D. 达到平衡后,降低温度A2气体的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
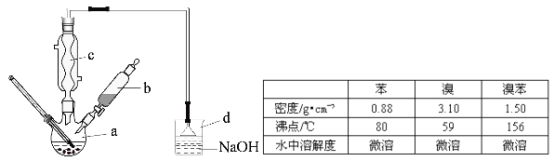
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com