
����Ŀ����ˮ�Ȼ�����������������Ӧ�ù㷺��
��1���Ȼ���ˮ��Һ��_____�ԣ�ԭ���ǣ������ӷ���ʽ��ʾ��________����AlCl3��Һ���ɣ����գ����õ�����Ҫ���������_______��
��2����ҵ������������Ҫ�ɷ�ΪAl2O3������Fe2O3��SiO2�����ʣ���ȡ��ˮ�Ȼ�����һ�ֹ�������ʾ�����£�
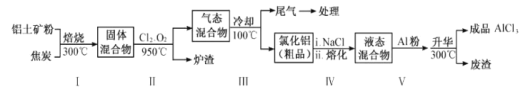
��֪��
���� | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
�е�/�� | 57.6 | 180�������� | 300�������� | 1023 |
�ٲ�����б���ʹ����ˮ�ֻӷ���������Ŀ���࣬��������___________��ֻҪ��д��һ�֣���
�ڲ����������ͨ����������������Ӧ�������ԭ�������ȹ��ĵ�����_____��
�� ��֪��
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ��H1=+1344.1kJ ��mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ��H2=+1169.2kJ ��mol-1
��Al2O3��C��Cl2��Ӧ����AlCl3���Ȼ�ѧ����ʽΪ______________��
�ܲ������ȴ�����º�������������NaOH����Һ���գ����ɵ�����Ҫ��3�֣��仯ѧʽ�ֱ�Ϊ_______�� _______ �� _________��
�ݽ�����̼�������ݷ�����������м������۵�Ŀ����___________________��
���𰸡��� Al3����3H2O![]() Al(OH)3��3H�� Al2O3 ��ֹ�����������ɵ�AlCl3ˮ�������Ӧ��ĽӴ�������ӿ췴Ӧ���� Fe���� Al2O3(s)��3C(s)��2Cl2(g)=2AlCl3(g)��3CO(g) ��H=��174.9kJ��mol��1 NaCl NaClO Na2CO3 ��ȥFeCl3�����AlCl3����
Al(OH)3��3H�� Al2O3 ��ֹ�����������ɵ�AlCl3ˮ�������Ӧ��ĽӴ�������ӿ췴Ӧ���� Fe���� Al2O3(s)��3C(s)��2Cl2(g)=2AlCl3(g)��3CO(g) ��H=��174.9kJ��mol��1 NaCl NaClO Na2CO3 ��ȥFeCl3�����AlCl3����
��������
��1��AlCl3����ǿ�������Σ�Al3+ˮ����Һ�����ԣ������������ˮ��ƽ���Ӱ�����AlCl3��Һ���ɡ����պ�õ��Ĺ��塣
��2��������ۺͽ�̿����ʹ����ˮ�ֻӷ���������Ŀ���ࡣ���������Cl2��O2��950�淴Ӧ����FeCl3��AlCl3��SiCl4��CO2��������������ʵķе㣬����������ȴ��100�棬�õ��Ĵ�Ʒ�к�AlCl3��FeCl3��β���к�Cl2��O2��CO2��SiCl4�ȣ�����V�м���Al�۳�ȥFeCl3��
(1)AlCl3Ϊǿ�������Σ�Al3����ˮ��ʹ����Һ�����ԣ�ˮ�����ӷ���ʽΪAl3����3H2O![]() Al(OH)3��3H������AlCl3��Һ���ɣ�����HCl���лӷ��ԣ�����Һ���ݳ����ٽ�Al3����ˮ�⣬����Al3+��ȫˮ������Al(OH)3���������ɡ����գ�Al(OH)3�ֽ�����Al2O3��
Al(OH)3��3H������AlCl3��Һ���ɣ�����HCl���лӷ��ԣ�����Һ���ݳ����ٽ�Al3����ˮ�⣬����Al3+��ȫˮ������Al(OH)3���������ɡ����գ�Al(OH)3�ֽ�����Al2O3��
(2) �ٲ�����б���ʹ����ˮ�ֻӷ���������û��ˮ�����Է�ֹ�����������ɵ�AlCl3ˮ�⡣������Ŀ���࣬ʹ�����ʱ�������ӿ컯ѧ��Ӧ���ʣ�
�ڲ���II�����ͨ����������������������е�Al2O3��Fe2O3��SiO2����C�����û���Ӧ���õ�Al��Fe��Si�����ԭ�������ȹ��ĵ�����Fe��
����������Ӧ���Ϊ��Ӧ�١���Ӧ�ڣ�Ӧ�ø�˹���ɣ�����Ӧ������Ӧ�ڣ����Եõ����跽��ʽAl2O3(s)+3C(s) +3Cl2(g)= 2AlCl3(g)+3CO(g)��H= +1344.1kJ ��mol-1-��+1169.2kJ ��mol-1��=��174.9kJ��mol��1�����Ȼ�ѧ����ʽΪAl2O3(s)��3C(s)��2Cl2(g)=2AlCl3(g)��3CO(g) ��H=��174.9kJ��mol��1��
��β���к�Cl2��O2��CO2��SiCl4�ȣ���ȴ�����º�������к�Cl2��O2��CO2������������NaOH����Һ���գ�������������NaOH����Һ�ķ�ӦΪ��Cl2��2NaOH=NaCl��NaClO��H2O��CO2��������NaOH����Һ�ķ�ӦΪ��CO2+2NaOH=Na2CO3+H2O������3�����ηֱ�ΪNaCl��NaClO��Na2CO3��
�ݲ������������FeCl3�����ݱ��е����ݣ����Ȼ����Ĵ�Ʒ�к���FeCl3���ʣ�����Al������FeCl3��Ӧ�û�����������AlCl3�����AlCl3�Ĵ��ȡ�


 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ȼ���ˮ������ӷ���ʽΪ_________________________________�������Ȼ�����Һ�����ɲ����յõ�_______(�ѧʽ)��
��2��25��ʱ��NH4Cl��Һ��_________�ԣ�ԭ���ǣ������ӷ���ʽ��ʾ��__________�������������İ�ˮ��ʹ��Һ��c��NH4+��=c��Cl����������Һ��pH___7�����������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��Na2O2��ˮ�ķ�Ӧ��ʵ����ͼ������֪��H2O2 ![]() H+ + HO2-��HO2-
H+ + HO2-��HO2- ![]() H+ + O22-�����з�������ȷ����
H+ + O22-�����з�������ȷ����
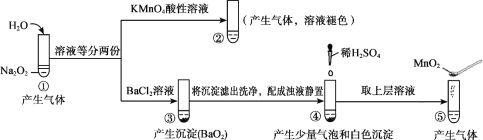
A. �١����в�����������ʹ�����ǵ�ľ����ȼ
B. �١����о�������������ԭ��Ӧ���ֽⷴӦ
C. �ڡ�����KMnO4��MnO2�����ò�ͬ�������������Ҳ��ͬ
D. ͨ�����ܱȽ����ԣ�HCl��H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L�ܱ������г���4mol A�����3mol B���壬�������з�Ӧ��2A(g)+B(g)![]() C(g)+xD(g)��5s�ﵽƽ�⡣�ﵽƽ��ʱ��������1mol C���ⶨD��Ũ��Ϊ2mol/L��
C(g)+xD(g)��5s�ﵽƽ�⡣�ﵽƽ��ʱ��������1mol C���ⶨD��Ũ��Ϊ2mol/L��
(1)��x =____��
(2)�����ʱ��A��ƽ����Ӧ����Ϊ_____ mol��L-1��s-1��
(3)ƽ��ʱB��Ũ��Ϊ______ mol��L-1��
(4)A��ת����Ϊ_________��(ת����a=![]() )
)
(5)5s�ﵽƽ�⣬�����ڻ�������ƽ����Է�����������ʼʱ______![]() ������������С���������������ͬ
������������С���������������ͬ![]() ����������ܶȱ���ʼʱ______��
����������ܶȱ���ʼʱ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ʵ�飨ͼ��a��b��c��ʾֹˮ�У���
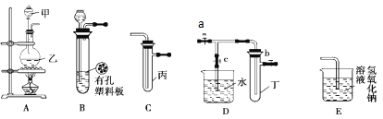
�밴Ҫ����գ�
��1��Aװ���м���������Ϊ______��
��2��A��C��E�������װ�ÿ�������ȡCl2��������ص�����ʵ�顣
�� A����ΪMnO2���壬����ʢ��Ũ���ᣬ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_____________��
�� ���ڱ��м�������ˮ�������Ƶ���ˮ����������ˮ�ֳ����ݣ����Т�����ʵ�飬ʵ�����������������£�
��. ����ˮ����Ʒ����Һ�У�����________________��
��. ��ˮ�м��� NaHCO3��ĩ������ɫ���ݲ�����ijͬѧ�ó����ۣ�������ˮ��Ӧ�IJ�����н�ǿ�����ԡ��������۸�ͬѧ�Ľ����Ƿ������������������˵�����ɡ� ___________________
��Eװ�õ�����__________________��
��3��B��D��Eװ����������B��ʢװŨ�����ͭƬ�������п����ϰ��ϣ����ر�ֹˮ��c���Ƶ�NO2�������ٽ����й�ʵ�顣
�� ����Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ��_____���ٴ�ֹˮ��_____��ʹ�ձ��е�ˮ�����Թܶ��IJ�����_________________��
�� NO2β������NaOH��Һ���������������Σ�д����Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����

A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g) ![]() xC(g)+2D(g)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol/L�������жϴ������
xC(g)+2D(g)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol/L�������жϴ������
A. x=1
B. B��ת����Ϊ80%
C. 2min��A��ƽ����Ӧ����Ϊ0.3 mol��L-1��min-1
D. �����������ܶȲ��䣬Ҳ����˵���÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯��
��1��ʵ���з��֣���Ӧ����е��¶����ߣ����е��¶Ƚ��͡��ɴ��ж�����������ķ�Ӧ��__�ȷ�Ӧ��Ba(OH)28H2O��NH4Cl��Ӧʱ����Ҫ��������ϸ��Ŀ����_����Ӧ����__(����������������)�������仯����ͼ��ʾ��
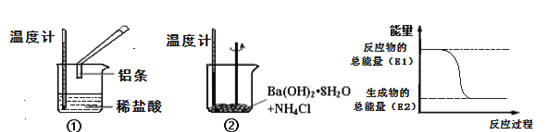
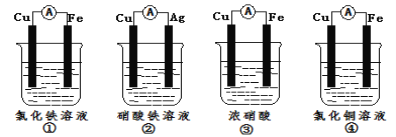
��2��Ϊ����֤Fe3+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ����_(�����)��
��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ��ʾ(a��bΪ���̼��)����_(��A��B)���缫���ͨ���飬�����ı���¼���33.6Lʱ����������ת����Ϊ90%��������ת�Ƶ��ӵ����ʵ���Ϊ__mol��
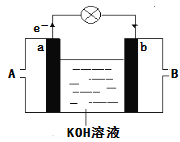
��4����ͼ��ij��ѧ��ȤС��̽����ͬ�����»�ѧ��ת��Ϊ���ܵ�װ�á���ش��������⣺
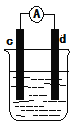
�ٵ��缫cΪAl���缫dΪCu���������ҺΪϡ����ʱ��д����ԭ��������ĵ缫��ӦʽΪ__��
�ڵ��缫cΪAl���缫dΪMg���������ҺΪ����������Һʱ����ԭ��صĸ�����ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a mol Na2O2��b mol NaHCO3�����Ϻ����ܱ������м��ȵ�250 ����ʹ���ַ�Ӧ�����ų�O2��H2O(g)�����ʵ���֮��Ϊ1��1 ʱ��a��bΪ
A��1��1 B��1��2 C��2��3 D��2��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com