
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
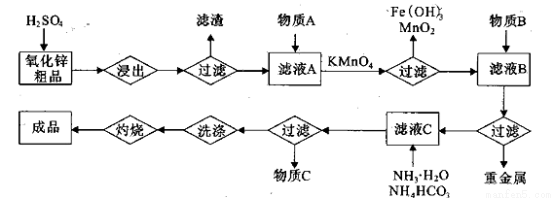
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、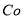 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
A.NH3.H2O B.Na2CO3 C. H2SO4 D.ZnO
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:

该温度下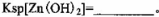 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中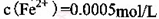 ,则处理1
,则处理1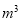 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、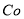 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是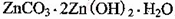 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
(每空2分,共14分)
(1) D ; 1.0×10-20.2
(2)2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ; 26.33
(3)锌粉
(4)3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4 ;
向最后一次的洗涤液中滴入1~2滴BaCl2 溶液,若无明显的现象,则沉淀已洗净。
【解析】
试题分析:(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌 调节溶液的pH值,答案选D;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,所以该温度下Zn(OH)2的Ksp= c(OH-)2×c(Zn2+)=1.0×10-20.2
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为0.5mol/3×158g/mol=26.33g;
(3)杂质Cu2+、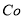 2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3·2Zn(OH)2·H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4 ; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2 溶液,若无明显的现象,则沉淀已洗净。
考点:考查对流程的分析,溶度积的计算,化学方程式、离子方程式的判断与书写,氧化还原反应的计算,洗涤操作的判断


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:选择题
下列实验方案中,不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
催化加氢可生成 3-甲基己烷的是
A.CH2=CHCH(CH3)CH2CH2CH2CH3 B.CH2=CH-CH(CH3)-C≡CH
C.CH2=CH-C(CH3)=CHCH2CH3 D.CH3CH2CH2CH2C(CH3)=CH2
查看答案和解析>>
科目:高中化学 来源:2013年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
查看答案和解析>>
科目:高中化学 来源:2013年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
下列说法正确的是
A.糖类化合物都具有相同的官能团 B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇 D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
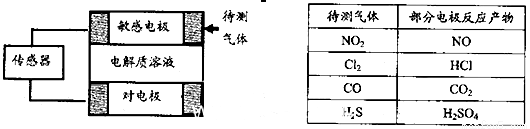
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为: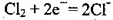
C.检测H2S气体时,对屯极充入空气,对电极上的电极反应式为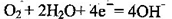
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:填空题
(16分) 以食盐为原料进行生产并综合利用的某些过程如下图所示。
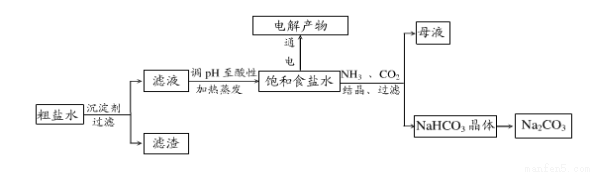
除去粗盐中的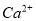 、
、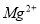 和
和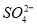 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
A.  B.
B.  C.
C. 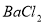
(2)将滤液的 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。
(3)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是_____,在X极附近观察到的现象是________________;Y电极上的电极反应式是______,检验该电极反应产物的方法是_______________ 。电解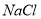 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
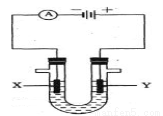
(4)若向分离出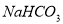 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
(5)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
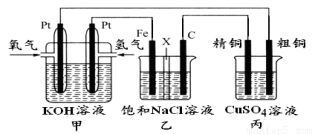
根据要求回答相关问题:
①通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
②石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_ 区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为______________。
④若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出铜的质量为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
下列有关金属铁的腐蚀与防护,说法正确的是
A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.铁与电源正极连接可实现电化学保护
D.将钢管与铜管一起堆放时可保护钢管少受腐蚀
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:选择题
将4g NaOH固体溶解在水里,配得1L溶液,溶液的物质的量浓度是
A.10 mol/L B.1mol/L C.0.1 mol/L D.0.01 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com