
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )

①可以使酸性高锰酸钾溶液褪色 ②可以和NaOH溶液反应 ③在一定条件下可以和乙酸发生反应 ④在一定条件下可以发生消去反应 ⑤在一定条件下可以和新制Cu(OH)2反应
A.①②③ B.①②③④
C.①②③⑤ D.①②④⑤
科目:高中化学 来源: 题型:
用化学用语填空
(1)地壳中含量最多的金属元素 ________ (2)2个硫原子
(3)保持氮气化学性质的最小微粒 (4)3个镁离子
(5)水中氧元素的化合价为—2价 (6)氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是来源丰富,在使用时对环境无污染或污染很小,且可以再生。下列满足未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能
⑥风能 ⑦氢
A.①②③④ B.④⑤⑥⑦
C.③⑤⑥⑦ D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉末。使用时加入水与其中的镁反应放出热量。下面是在室温下对本产品的两个探究实验。
实验1:向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果见下图。

①1.0 mol镁条、0.10 mol铁粉、0.10 mol氯化钠粉末;
②将1.0 mol镁条剪成100份、0.10 mol铁粉、0.10 mol 氯化钠粉末;
③1.0 mol镁粉、0.10 mol 铁粉、0.10 mol氯化钠粉末;
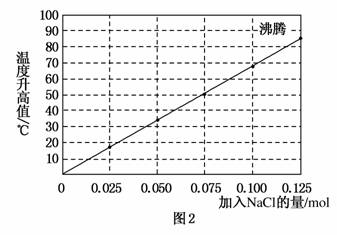
实验2:向加有100 mL水的多个相同的隔热容器中分别加入由0.10 mol镁粉、0.50 mol铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15 min时记录温度升高的幅度,结果见图2。
请回答下列问题:
(1)实验1证实了该反应的反应速率与________有关。
(2)实验2中当NaCl的用量大于0.125 mol时,实验就无须再做的原因是________(填选项字母)。
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入0.060 mol的NaCl,则第15 min时混合物的温度最接近于________(填字母)。
A.34 ℃ B.42 ℃
C.50 ℃ D.62 ℃
(4)加入铁粉和NaCl能使反应速率加快的原因是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.一定条件下可以用H2除去乙烷中混有的乙烯
B.苯和四氯化碳都能萃取溴水中的溴
C.乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 物质的化学变化都伴随着能量变化 |
|
| B. | 凡是吸热反应都需要加热 |
|
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O △H=﹣57.3 kJ•mol﹣1 |
|
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

|
| A. | b代表0℃下CH3COCH3的Y﹣t曲线 |
|
| B. | 反应进行到20min末,CH3COCH3的 |
|
| C. | 升高温度可缩短反应达平衡的时间并能提高平衡转化率 |
|
| D. | 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)(Ⅰ)
达平衡时,CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 .
②该反应的△H 0,△S 0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)⇌ CH3OH(g) △H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是 (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
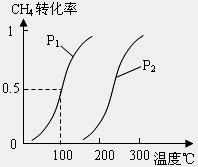
图1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,H2S的电离常数Ka1、Ka2满足 Ka1·Ka2=3×10-22,H2S饱和溶液物质的量浓度约为0.10mol·L-1;Ksp(CuS)=6×10-36,Ksp(MnS)=4.5×10-14。下列说法正确的是
A.相同温度下,CuS在水中的溶解度比MnS小
B.CuS和MnS一定都溶于强酸
C.反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+ K=7.5×1021
D.在浓度均为0.01mol·L-1Cu2+和Mn2+混合溶液中,通入H2S只有MnS沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com