
(8分)SO2、NO是大气污染物。工业上吸收SO2 和NO,同时获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
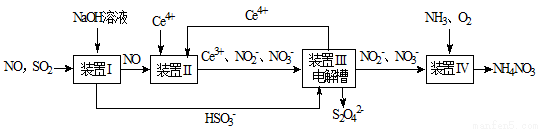
(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅲ中,电解槽的阳极发生的电极反应为 ;
(4)从装置Ⅳ中获得粗产品NH4NO3的实验操作依次为 、 、过滤、洗涤等。
(8分)
(1)SO2 + OH-== HSO3- (2分)
(2)HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,
SO32-+H+,加入CaCl2溶液后,
Ca2++SO32-== CaSO3↓使电离平衡右移,c(H+)增大。(2分)
(3)Ce3+ - e— == Ce4+ (2分)
(4)蒸发浓缩、冷却结晶 (2分)
【解析】
试题分析:(1)过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢根离子,离子方程式为SO2 + OH-== HSO3-;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,是因为亚硫酸氢钠溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-== CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-== CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
(3)根据流程图可知,装置III电解槽中的硝酸根离子、亚硝酸根离子未变化,亚硫酸氢根离子变为S2O42-,S的化合价降低,Ce3+变为Ce4+,Ce的化合价升高,所以阳极发生的反应是Ce3+ - e— == Ce4+ ;
(4)从溶液中得到晶体的操作是蒸发浓缩、冷却结晶,然后过滤、洗涤得到产品。
考点:考查对流程图的分析,溶液中的平衡应用,电化学反应原理,基本操作的判断


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:2015届安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:选择题
为了检验某种晶体的成分,下列实验叙述中正确的是( )
A.观察样品呢 ,呈块状、绿色,该晶体中肯定有铜离子
B.用纯净的铂丝蘸取该样品的溶液,置于酒精灯火焰上灼烧,火焰呈黄色,说明样品中有Na+但不一定无K+
C.取适量该晶体溶于蒸馏水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取少量该晶体放入试管中,加热,将产生的气体通过硫酸铜粉末,硫酸铜粉末变蓝,则可证明晶体的成分中含有结晶水
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
心脏起搏器一般是给心跳缓慢的病人使用。某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2=4LiCl+S+SO2下列有关判断正确的是
A.还原剂只有锂
B.SOCl2中既有离子键,也有共价键
C.氧化产物包括LiCl和SO2
D.标准状况下生成1.12LSO2时,反应转移电子为0.1mol
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
同温同压下,等体积的两容器内分别充满14N16O和,13C16O气体,下列对两容器中气体判断正确的是
A.质量相同 B.分子数不同 C.中子数相同 D.质子数相同
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是
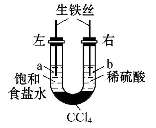
A.铁丝在两处的腐蚀速率:a < b
B.a、b两处相同的电极反应式为Fe-2e-==Fe2+
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
下列所述事实与化学(离子)方程式不相符的是
A.能说明非金属性Cl > C: 2HCl+CaCO3==CaCl2+CO2↑+H2O
B.能说明氧化性H2O2 > Fe3+: 2Fe2++H2O2+2H+ ==2Fe3++2H2O
C.已知:H+(aq)+OH—(aq)==H2O(l) ΔH=-57.3kJ·mol-1(稀溶液),能说明稀硫酸与NaOH稀溶液反应生成1mol水,放出的热量为57.3 kJ
D.能说明CH3COOH是弱电解质: CH3COO—+H2O  CH3COOH+OH—
CH3COOH+OH—
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是
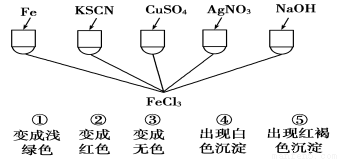
A.只有④ B.只有③ C.③和④均错 D.全部错误
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:填空题
重要的精细化学晶M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示:
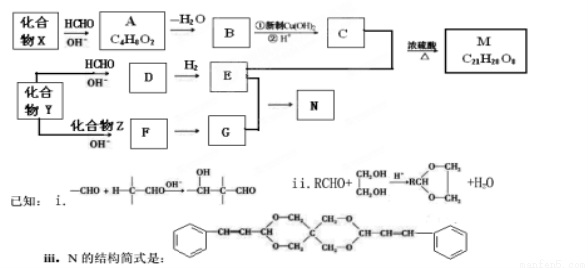
请回答下列问题:
(1)A中氧官能团的名称为__________________.由A生成B的反应类型为________________
(2)X的结构简式为______________________
(3)由B生成C的反应①的化学方程式为______________________
(4)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式为___________
(5)E的结构简式为_______________,E的同分异构体有多种,其中与E具有相同官能团的同分异构体有_____________种(提示:同一碳原子上连有两个或以上羟基是不稳定的,)试写出其中一种的结构简式______________.
(6)下列说法正确的是( )
A、E能发生消去反应 B、1mol M中含有4mol 酯基
C、X与Y是同系物 D、1mol G与足量H2加成可消耗2mol H2
(7)由Y生成D的化学方程式为_________________________
(8)Z的结构简式为___________________________.
(9)由F生成G的化学方程式为__________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com