
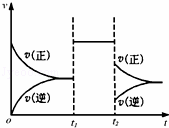
可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)﹣时间(t)图象如图.则下列说法正确的是( )
|
| A. | 若X是固体,则t1时一定是增大了容器的压强 |
|
| B. | 若X是气体,则t2时可能是增大了容器的压强 |
|
| C. | 若X是固体,则t1时可能是增大了X的质量 |
|
| D. | t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0 |
考点:
化学反应速率的影响因素;化学平衡的影响因素.
专题:
化学平衡专题.
分析:
由图可知,可逆反应到达平衡后,在t1时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t2时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,根据以上分析进行判断.
解答:
解:由图可知,可逆反应到达平衡后,在t1时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t2时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,
A、若X是固体,反应前后气体体积不变,压强不影响化学平衡,可以增大压强来改变平衡,但是加入催化剂也可以出现同样效果,所以不一定是增大了压强,故A错误;
B、若X是气体,反应前后气体体积变大,则t2时增大了容器的压强,正逆反应速率都应该增大,不是减小,故B错误;
C、若X是固体,则t1时可能是增大了X的质量,对化学平衡没有影响,故C错误;
D、由于a+2≥2,反应物的气体体积不会小于生成物的气体体积,减小压强平衡不移动或者向着逆向移动,不会出现正反应速率大于逆反应速率,所以一定不是减小压强;若是降低温度,v(正)>v(逆),平衡向着正向移动,正反应是放热反应,△H<0,故D正确;
故选D.
点评:
考查化学平衡移动影响因素、化学平衡图象等,难度中等,根据外界条件对平衡的影响分析图象变化的可能原因是关键.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
关于化学反应中能量变化的说法不符合事实的是( )
|
| A. | 化学键断裂吸收能量,化学键生成放出能量 |
|
| B. | 化学反应中有物质变化也有能量变化 |
|
| C. | 需要加热的化学反应不一定是吸热反应 |
|
| D. | 图中所示的反应为放热反应
|
查看答案和解析>>
科目:高中化学 来源: 题型:
在﹣50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)⇌N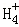 +N
+N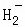 ,N
,N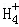 的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
|
| A. | 在液氨中加入NaNH2,可使液氨的离子积变大 |
|
| B. | 在液氨中加入NH4Cl,液氨的离子积不变 |
|
| C. | 此温度下液氨的离子积K为1×10﹣30 |
|
| D. | 在液氨中加入金属钠可能有NaNH2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中正确的是( )
|
| A. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
|
| B. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
|
| C. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
|
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和另一种常见气体.进一步研究NH3生成量与温度的关系(其它条件均相同),部分实验数据见下表:
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
回答下列问题:
(1)写出该反应的化学方程式
(2)该反应的焓变△H 0(填“>”、“<”或“=”)
(3)请在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
(4)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(5)已知:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol
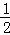 N2(g)+2H2(g)+
N2(g)+2H2(g)+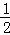 Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,在3支体积不同的试管中分别充满等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2.现将3支试管均倒置于水槽中,充分反应后,试管中溶质的物质的量浓度分别为c1、c2、c3(假设溶质全在试管中),则下列关系正确的是()
A. c1>c2>c3 B. c1>c3>c2 C. c1=c3>c2 D. c1=c2>c3
查看答案和解析>>
科目:高中化学 来源: 题型:
1996年诺贝尔化学奖授予斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域.后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键.对于C60与棒碳,下列说法正确的是( )
|
| A. | C60与棒碳中所有的化学键都是非极性共价键 |
|
| B. | 棒碳不能使溴水褪色 |
|
| C. | C60在一定条件下可能与CuO发生置换反应 |
|
| D. | 棒碳与乙炔互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )

A.反应的化学方程式为:2MN
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com