
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 乙烯和丙烯组成的42g混合气体中碳氢键数目为6NA
B. 标准状兄下,22.4L二氯甲烷的分子数约为NA
C. 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为12NA
D. 将1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于NA
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-1gc。常温下,某浓度的H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)的变化如图所示。下列说法正确( )
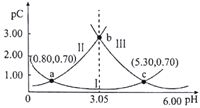
A. 曲线Ⅱ表示pC(HA-)随pH的变化
B. 当pH=1.40时,c(H2A)>c(A2-)>c(HA-)
C. 常温下,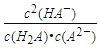 =104.50
=104.50
D. a、b、c三点对应的溶液中,c(H2A)+c(HA-)+c(A2-)的值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
(1)在T1、T2温度下,一定量的NO(g)发生分解反应时,N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H_____0(填“>"或“<”)。
2NO(g)的△H_____0(填“>"或“<”)。
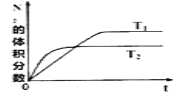
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=_________。该温度下,若增大压强此反应的平衡常数将_________(填“增大”、“减小”、“不变”或“无法确定”),若向上述容器中再充入2molN2(g)与1molO2(g),则再次达到平衡时O2的转化率________(填“增大”、“减小”、“不变”或“无法确定”)。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染,从而达到脱硝的目的:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJmol-1
甲烷直接被NO2还原为N2的热化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中( )
A. c(NH4+)<c(Cl-) B. c(NH4+)=c(Cl-)
C. c(NH4+)>c(Cl-) D. 无法确定c(NH4+)与c(Cl-)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1℃时,在四个容积均为1L的恒容密闭容器中发生反应:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
容器编号 | 物质的起始浓度 (mol/L) | 速率 (mol·L-1·s-1) | 物质的平衡浓度 (mol/L) | |
c(NO) | c(H2) | c(N2) | ||
Ⅰ | 6×10-3 | 1×10-3 | a×10-3 | 2×10-4 |
Ⅱ | 6×10-3 | 2×10-3 | 2a×10-3 | |
Ⅲ | 1×10-3 | 6×10-3 | b×10-3 | |
Ⅳ | 2×10-3 | 6×10-3 | 4b×10-3 | |
下列说法正确的是
A. m=2,n=1
B. 达到平衡时,容器Ⅱ与容器Ⅳ的总压强之比为1:2
C. 温度升高为T2℃,测得平衡时,容器Ⅱ中c(H2O)=3.8×10-4mol/L,则ΔH>0
D. T1℃时,容器Ⅲ中达到平衡后再充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com