
���� �ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ����D�к���Cu2+���ӣ�
�ڽ�E��Һ���뵽C��Һ�У����ְ�ɫ�����������μӳ����ܽ⣬��C�к���Al3+���ӣ�E�к���OH-���ӣ�
�۽�����ɫ��Ӧʵ�飬ֻ��B��CΪ��ɫ����B��C����K+���ӣ�������ӹ��棬����E��NaOH��
���ڸ���Һ�м���Ba��NO3��2��Һ���ټ������ϡ���ᣬA�зų���ɫ���壬��A�к���HCO3-���ӣ�C��D�в�����ɫ��������C��D�к���SO42-���ӣ�����D��CuSO4��C��KAl��SO4��2��A��NaHCO3��
�ݽ�B��D����Һ��ϣ�δ���������������ɣ���B��KNO3������Al2��SO4��3��Һ��KOH��Һ�ķ�Ӧ���������20mL1mol/LAl2��SO4��3ȫת��Ϊ����������Ϊ��0.02L��2mol/L��78g/mol=3.12g������Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O����֪KOH�������������һ�Dz��㣬����ʹAl��OH��3�����ܽ⣬�Դ˼��㣮
��� �⣺�ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ����D�к���Cu2+���ӣ�
�ڽ�E��Һ���뵽C��Һ�У����ְ�ɫ�����������μӳ����ܽ⣬��C�к���Al3+���ӣ�E�к���OH-���ӣ�
�۽�����ɫ��Ӧʵ�飬ֻ��B��CΪ��ɫ����B��C����K+���ӣ�������ӹ��棬����E��NaOH��
���ڸ���Һ�м���Ba��NO3��2��Һ���ټ������ϡ���ᣬA�зų���ɫ���壬��A�к���HCO3-���ӣ�C��D�в�����ɫ��������C��D�к���SO42-���ӣ�����D��CuSO4��C��KAl��SO4��2��A��NaHCO3��
�ݽ�B��D����Һ��ϣ�δ���������������ɣ���B��KNO3��
��1��������������֪��AΪNaHCO3��BΪKNO3��CΪKAl��SO4��2��DΪCuSO4��
�ʴ�Ϊ��KNO3��CuSO4��
��2��A��NaHCO3��E��NaOH��1mol A����Һ�뺬1mol E����Һ��Ӧ����̼���ƺ�ˮ�����ɹ�����̼����ˮ��õ�̼���������������ƣ����ն����ַ�Ӧ�õ�Na2CO3��
�ʴ�Ϊ��Na2CO3 ��
��3��C�к��������ӣ���������ˮ�����������������壬������������ԣ�������ˮ �е����������ˮ��ˮ�ⷴӦ����ʽΪ��Al3++3H2O?Al��OH��3�����壩+3H+��
�ʴ�Ϊ��Al3++3H2O?Al��OH��3�����壩+3H+��
��4����NaHCO3��Һ�м�����������ʯ��ˮ�������ӷ���ʽΪ2HCO3-+Ca2++2OH-=CaCO3��+CO32-+H2O��
�ʴ�Ϊ��2HCO3-+Ca2++2OH-=CaCO3��+CO32-+H2O��
��5��20mL2mol/L AlCl3��ȫת��Ϊ����������Ϊ0.02L��2mol/L��78g/mol=3.12g������Al3++3OH-�TAl��OH��3����Al��OH��3+OH-�TAlO2-+H2O����֪NaOH�������������һ�Dz��㣬����ʹAl��OH��3�����ܽ⣬��NaOH��Ũ��Ϊc����NaOH����ʱ��
Al3++3OH-�TAl��OH��3��
3mol 78g
0.03L��c 0.78g
����c=$\frac{3mol��0.78g}{0.03L��78g}$=1mol/L��
��NaOHʹAl��OH��3�����ܽ�ʱ����NaOH�����ʵ���Ϊx�����ݷ�Ӧ��
Al3++3OH-�TAl��OH��3��
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al��OH��3 +OH-�TAlO2-+H2O
78g 1mol
��3.12-0.78��g ��x-0.12mol��
��ã�x=0.15mol��
��NaOH�����ʵ���Ũ��Ϊ��c=$\frac{0.15mol}{0.03L}$=5mol/L��
�ʴ�Ϊ��1��5��
���� ���⿼�������ƶϣ�����δ֪��ļ����ƶϣ��漰���ӹ��桢���ӷ�Ӧ�ȣ��ؼ���ȷ����֮�䷢���ķ�Ӧ��������������ѧ������˼ά���������ͣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
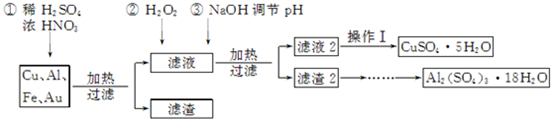
| �¶ȣ�K�� | ʧ�أ�%�� | |
| ��һ�� | 323��523 | 40.54 |
| �ڶ��� | 553��687 | 48.65 |
| ������ | 1 043���� | 84.68 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
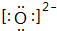 ��
��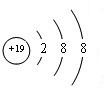 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ������ĵ缫��X��Ϊ��صĸ�����ͨ�������ĵ缫��Y��Ϊ������� | |
| B�� | �ŵ�һ��ʱ��������Һ��KOH�����ʵ������ı� | |
| C�� | �ڱ�״���£�ͨ��5.6L��������ȫ��Ӧ����1.0mol�ĵ��ӷ���ת�� | |
| D�� | �ŵ�ʱ��ͨ�������һ��������pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 11.2g | B�� | 5.6g | C�� | 2.8g | D�� | ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com