
 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:分析 (1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;根据化合价变化判断反应中SO2和Fe3+的物质的量之比;
(2)实验室制取气体要考虑操作方便、易控制、不能含杂质;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(4)蒸发用到蒸发皿、石棉网、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,据此进行解答;
(5)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析.
解答 解:(1)二氧化硫与铁离子反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,反应中铁离子被氧化成亚铁离子,所以还原产物为亚铁离子;
参加反应的SO2和Fe3+的物质的量之比=其计量数之比=1:2,
故答案为:Fe2+;1:2;
(2)A.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸钠,无法得到二氧化硫气体,故A错误;
B.浓硫酸虽具有强酸性,且浓硫酸不挥发,亚硫酸钠溶液与浓硫酸能够反应生成二氧化硫气体,故B正确;
C.固体硫在纯氧中燃烧,操作不容易控制,且无法获得纯净的二氧化硫,故C错误;
故答案为:B;
(3)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:吸收SO2尾气,防止污染空气;
(4)蒸发操作使用仪器有:A.蒸发皿、D.玻璃棒;过滤使用仪器为:C.漏斗、D.玻璃棒,所以没有使用到的是:B.石棉网,
故答案为:B;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以方案①不合理,
故答案为:方案①;因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色;
(6)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,
故答案为:B中蓝色溶液褪色.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化还原反应的计算、氧化性还原性强弱比较、性质实验方案的设计与评价等知识,侧重学生分析能力和计算能力的考查,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液中加入足量的乙酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 向氨基乙酸溶液中滴入NaOH溶液:H2NCH2COOH+OH-→H2NCH2COO-+H2O | |
| D. | 向氯化铁溶液中加入足量的铁:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.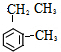 .
. (假设按1:1:1的单体比例合成).
(假设按1:1:1的单体比例合成). ,制取写出相关的化学方程式:
,制取写出相关的化学方程式: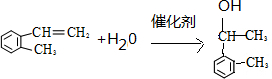 、
、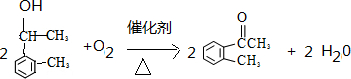 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35% | B. | 70% | C. | 17.5% | D. | 0.035% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com