
| A. | 用碘水可以鉴别葡萄糖溶液和淀粉溶液 | |
| B. | 淀粉、油脂和蛋白质在一定条件下都能发生水解反应 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 向蛋白质溶液中加入浓的CuSO4溶液均可使蛋白质盐析而分离提纯 |
分析 A、碘遇淀粉变蓝;
B、淀粉、油脂、蛋白质均可水解;
C、油脂在碱的催化作用下水解生成肥皂;
D、蛋白质溶液遇重金属盐发生蛋白质变性.
解答 解:A、碘遇淀粉变蓝,碘遇葡萄糖无变化,故可以鉴别,故A正确;
B、淀粉在稀硫酸的作用下水解为葡萄糖,油脂属于酯类,能水解为高级脂肪酸和甘油,蛋白质均可水解为氨基酸,故B正确;
C、油脂在碱的催化作用下发生皂化反应,能水解生成的硬质酸钠是肥皂的主要成分,故能生成肥皂,故C正确;
D、硫酸铜溶液是重金属盐,能使蛋白质变性,故蛋白质溶液遇CuSO4溶液,发生蛋白质变性,故D错误;
故选D.
点评 本题考查了糖类、油脂、蛋白质的组成、结构和性质,合成纤维、胶体的性质等知识,涉及较为全面,掌握物质的性质是解题的关键.


科目:高中化学 来源: 题型:选择题
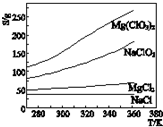
| A. | 将NaCl溶液蒸干可得NaCl固体 | |
| B. | 可用MgCl2和NaClO3制备Mg(ClO3)2 | |
| C. | 将MgCl2溶液蒸干可得MgCl2固体 | |
| D. | Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 类别 | 物质 |
| A | 碱性氧化物 | Na2O2 CuO MgO |
| B | 难溶性物质 | Ba(OH)2 MgSO4 Na2SiO3 |
| C | 弱酸 | H2S H2SO4 CH3COOH |
| D | 强电解质 | AgCl MgSO4 CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 少量SO2气体通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | Ca(HCO3)2溶液和少量NaOH溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核聚变如${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,因为有新微粒生成,所以该变化是化学变化 | |
| B. | 电子层数越多,半径越大 | |
| C. | 共价化合物分子间均存在分子间作用力 | |
| D. | H2O的稳定性大于H2S,是因为水分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
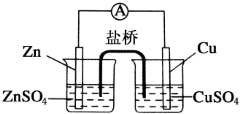 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com