
分析 分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒规律及原子个数守恒规律配平方程式;
氧化还原反应中,氧化剂氧化性强于氧化产物氧化性,依据方程式判断氧化剂与氧化产物,据此判断氧化性强弱顺序.
解答 解:(1)该反应中元素的化合价变化如下:Cu→Cu(NO3)2,Cu元素的化合价由0价→+2价,一个Cu失去2个电子; HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
反应的方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,所以HNO3的化学计量数为8;
故答案为:8;
(2)反应中元素的化合价变化如下:Cl2→ClO3-,Cl元素的化合价由0价→+5价,一个Cl失去5个电子; Cl2→Cl-,N元素的化合价由0价→-1价,一个Cl得到1个电子,所以得失电子的最小公倍数为5,所以KClO3的计量数为1,KCl的计量数为5,根据原子守恒,KOH的计量数为6,H2O计量数为3,Cl2系数2,方程式:3Cl2+6KOH=5KCl+KClO3+3H2O,KOH的化学计量数为6;
故答案为:6;
(3)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,所以HCl的化学计量数为16;
故答案为:16;
(4)发生BiO3-→Bi3+的反应,Bi元素由+5价降低为+3价即发生还原反应,Mn2+→MnO4-,Mn元素由+2升高为+7,由电子守恒及质量守恒定律可知,该反应为2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O,H+的化学计量数为14;
故答案为:14;
(5)反应中铁元素从+2价升高为+3价,高锰酸根离子中锰元素从+7价降为+2价,要使得失电子守恒,则二价铁离子系数为5,高锰酸根离子系数为1,依据原子个数守恒反应的方程式:5Fe2++1MnO4-+8H+=5Fe3++1Mn2++4H2O,所以缺少的为:H+;
故答案为:H+;
(6)(4)中2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O,Bi元素由+5价降低为+3价即发生还原反应,则
BiO3-为氧化剂,Mn2+→MnO4-,Mn元素由+2升高为+7,MnO4-为氧化产物,依据氧化剂氧化性大于氧化产物氧化性可知氧化性:BiO3->MnO4-;
5Fe2++1MnO4-+8H+=5Fe3++1Mn2++4H2O,铁元素从+2价升高为+3价,Fe2+为还原剂,对应Fe3+为氧化产物,高锰酸根离子中锰元素从+7价降为+2价,MnO4-为氧化剂,依据氧化剂氧化性大于氧化产物氧化性可知氧化性:MnO4->Fe3+;
则:BiO3->MnO4->Fe3+;
故答案为:BiO3->MnO4->Fe3+.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及守恒法应用为解答的关键,侧重氧化还原反应配平及氧化性强弱的判断方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
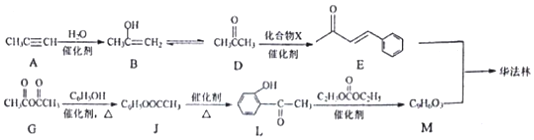
 .
.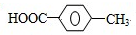 ,R→S的化学方程式为
,R→S的化学方程式为 .
.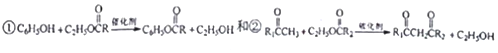
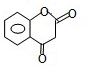 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和CO的混合气 | B. | C2H2O2 | C. | C3H6O3 | D. | C6H12O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示装置可用于多种实验.
如图所示装置可用于多种实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应 | |
| B. | 乙酸和乙醇均能与NaOH溶液发生反应 | |
| C. | 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯 | |
| D. | C5H11Br有8种同分异构体,它们的熔点、沸点各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
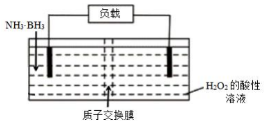 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | BO2-通过质子交换膜向正极移动 | |
| C. | 负极附近溶液pH增大 | |
| D. | 正极的反应式为 3H2O2+6H++6e-═6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com