
分析 (1)二价铁离子具有还原性,利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
(2)铁与浓硫酸加热生成硫酸铁,二氧化硫和水,所以Y为二氧化硫,二氧化硫具有还原性与溴水发生氧化还原反应生成硫酸和氢溴酸;
(3)6.0g的铁钉放入15.0mL浓硫酸中,加热,充分反应后得到溶液X,则X溶液中含有硫酸根离子,三价铁离子,氢离子;
(4)反应中铁元素化合价升高3价,浓硫酸中+6价的硫降为+4价,降2价,依据得失电子守恒、原子个数守恒书写方程式.
解答 解:(1)二价铁离子具有还原性,能够还原高锰酸钾,+2价亚铁离子能使酸化的高锰酸钾褪色,a、b都不能检验亚铁离子,只有d能检验溶液中含有+2价铁离子,选c会生成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选d,
故答案为:d;利用Fe2+的还原性和MnO4-的强氧化性,而使紫色MnO4-褪色;
(2)二氧化硫与溴水反应生成硫酸和氢溴酸,离子方程式:SO2+Br2+2H2O═4H++2Br-+SO42-;
故答案为:SO2+Br2+2H2O═4H++2Br-+SO42-;
(3)6.0g的铁钉放入15.0mL浓硫酸中,加热,充分反应后得到溶液X,则X溶液中含有硫酸根离子,三价铁离子,氢离子,
a.铁能够与氢离子、三价铁离子反应,不能共存,故a错误;
b.铜能与三价铁离子反应,不能共存,故b错误;
c.铜离子与氢离子、三价铁离子都不反应,能共存,故c正确;
d.SCN-与三价铁离子发生络合反应,不能共存,故c错误;
故选:c;
(4)反应中铁元素化合价升高3价,浓硫酸中+6价的硫降为+4价,降2价,依据得失电子守恒、原子个数守恒,方程式:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2、6、1、3、6.
点评 本题元素化合物知识,熟练掌握浓硫酸、三价铁离子的性质,氧化还原反应规律是解题关键,题目难度中等.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
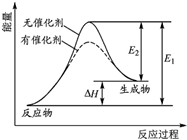 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能改变反应的路径,降低反应所需的活化能 | |
| D. | △H=E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
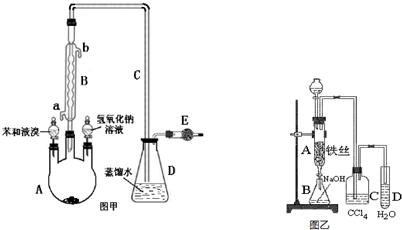
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
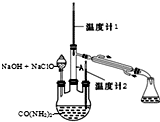 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com